
题目列表(包括答案和解析)
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。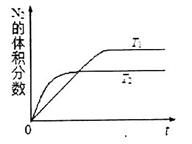
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。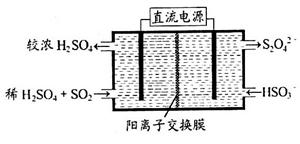
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L 的醋酸与b mol
的醋酸与b mol L
L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
 2NH3(g)的△H= 。
2NH3(g)的△H= 。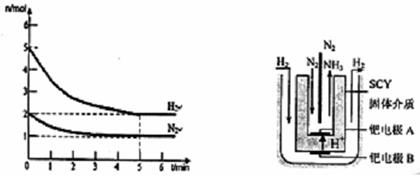
| | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 |
无机化学反应式
1、2Na+2H2O=2NaOH+H2↑ ★ 2K+2H2O=2KOH+H2↑
2、2Na2O2+2H2O=4NaOH+O2↑ 3、2Na2O2+2CO2=2Na2CO3+O2
4、氢氧化钠和碳酸氢钠在溶液中反应的离子方程式为:
OH- +HCO3- =CO32- +H2O
氯气溶于水(新制氯水中含Cl2.HClO.H2O .H+ .Cl - .ClO - .OH-):
5、Cl2+H2O=HCl+HClO ★ Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):
6、2HClO![]() 2HCl+O2↑
2HCl+O2↑
7、Ca(ClO)2+CO2+H2O=CaCO3+2HClO
8、MnO2+4HCl(浓)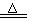 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
9、2F2+2H2O=4HF+O2 Cl2+H2O=HCl+HClO Br2+H2O=HBr+HBrO
10、2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2NaOH=2NaAlO2+H2O
Al(OH)3+NaOH=NaAlO2+2H2O
11、H2O2的分解: 2H2O2![]() 2H2O+O2↑ *H2S与SO2的反应: 2H2S+SO2=3S+2H2O
2H2O+O2↑ *H2S与SO2的反应: 2H2S+SO2=3S+2H2O
12、2SO2+O2![]() 2SO3
2SO3
13、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
14、C+2H2SO4(浓)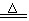 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
15、SiO2+2C![]() Si+2CO↑
Si+2CO↑
16、![]()
17、N2+O2 ![]() 2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
18、4NH3 +5O2 4NO+6H2O
4NO+6H2O
19、用浓盐酸检验氨气(白烟生成): NH3+HCl=NH4Cl
20、(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
21、NH4NO3+NaOH=NaNO3+NH3↑+H2O
22、4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
23、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
24、FeCl3+3KSCN![]() 3KCl+Fe(SCN)3
3KCl+Fe(SCN)3
25、盐类水解: CH3COO- +H2O![]() CH3COOH+OH- CO32- +H2O
CH3COOH+OH- CO32- +H2O![]() HCO3-+OH-
HCO3-+OH-
HCO3- +H2O![]() H2CO3+OH- NH4+ +H2O
H2CO3+OH- NH4+ +H2O![]() NH3?H2O+H+
NH3?H2O+H+
Fe3+ +3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
27、铝热反应: 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
4Al+3MnO2![]() 3Mn+2Al2O3
3Mn+2Al2O3
28、2Mg+CO2![]() C+2MgO
C+2MgO
29、Al2(SO4)3+6NH3·¤H2O=2Al(OH)3↓?+2(NH4)2SO4
30、NaAlO2+HCl+H2O=Al(OH)3↓? +NaCl ; NaAlO2+CO2+H2O=Al(OH)3↓? +NaHCO3
31、高温下铁与水反应 :3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
32、FeCl3+3NaOH=Fe(OH)3↓?+3NaCl
33、4Fe(OH)2+O2+2H2O=4Fe(OH)3
34、2FeCl2+Cl2=2FeCl3 2FeCl3+Fe=3FeCl2
35、氯化铁溶液中加入铜粉: 2FeCl3+Cu=2FeCl2+CuCl2
36、金属的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
CuO+C![]() Cu+CO↑
Cu+CO↑
![]()
37、铜锌原电池:正极:2H++2e- =H2↑
负极:Zn-2e- =Zn2+
38、钢铁的吸氧腐蚀:正极:O2+4e- +2H2O=4OH-
负极:Fe-2e- =Fe2+
39、Fe(OH)3胶体的制取:FeCl3 +3H2O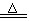 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
40、电解CuCl2溶液:阳极:2Cl- -2e- =Cl2↑
阴极:Cu2++2e- =Cu
总反应:CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
41、铜的电解精炼:阳极:Cu-2e- =Cu2+
阴极:Cu2++2e- =Cu
42、电镀铜:阳极:Cu-2e- =Cu2+
阴极:Cu2++2e- =Cu
43、电解饱和食盐水:阳极:2Cl- +2e-=Cl2↑
阴极:2H+ +2e- =H2↑
总反应:2NaOH+2H2O![]() H2↑+2NaOH+Cl2↑
H2↑+2NaOH+Cl2↑
44、黄铁矿的燃烧: 4FeS2 +11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
45、氨水吸收少量SO2: SO2+2NH3 +H2O=(NH4)2SO3
46、C+H2O(g)![]() CO+H2
CO+H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com