
题目列表(包括答案和解析)
| ||
. |
| ||
. |
| ||
| ||
A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
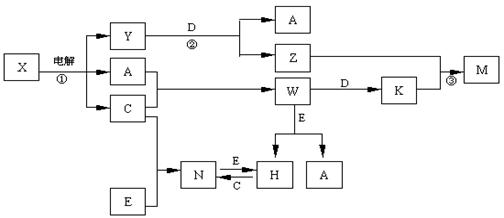
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族。
(2)反应③的离子方程式为 E的氧化物与D在一定条件下反应的化学方程式为: 。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为 。
![]()

A.①②
B.①③
C.③④
D.②④
一、选择题(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
B
C
B
A
A
D
D
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
C
A
C
D
D
B
B
B
21.(9分)(1)第三周期第IIA族 硫化氢(2)深红棕色
 |
(3)
(4)2F2+2H2O=4HF+O2 (5)Hg+S=HgS
22.(14分)(1)Fe、C、Si、Al (2)NO2、Fe(OH)3 (3) 、
、
 、
、 (4) C +4 HNO3(浓)===CO2 + 4NO2 + 2H2O
(4) C +4 HNO3(浓)===CO2 + 4NO2 + 2H2O
(5)2Al + 2NaOH + 2H2O ==2NaAlO2 + 3H2 或Si + 2NaOH + H2O ==Na2SiO3 + 2H2(6)SiO32- + 2H+ + H2O ==H4SiO4 或 AlO2- + H+ + H2O ==Al(OH)3
23. (15分)(2)蒸馏烧瓶 ;常温下,Fe被浓硫酸钝化,碳不与浓硫酸反应
(3)2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O)品红溶液逐渐褪色 强氧化
CO2↑+2SO2↑+2H2O)品红溶液逐渐褪色 强氧化
(4)2Fe3++Fe==3Fe2+(或Fe+2H+==Fe2++H2↑)
(5)铁碳在溶液中形成原电池
(6)×100%(或×100%或×100%) (7)B
24.(16分)(1)C8H8O2 (2)醛基,羟基 (3)甲、乙、丙;(4)甲:与FeCl3溶液作用显紫色;丙:与银氨溶液共热会发生银镜反应;(5)6种结构简式略
25.(6分)C3N6H6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com