
题目列表(包括答案和解析)
(分)苯甲酸甲酯:
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g·cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(![]() )是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
)是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化。
有关物质的物理性质见右表。
Ⅰ苯甲酸甲酯的合成和提纯。
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应;第二步:水洗提纯;第三步:蒸馏提纯。
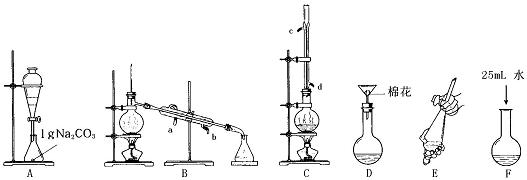
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有15.0g苯甲酸和20.0mL过量的甲醇外,还需要加入___________、______________ 。
(3)步聚F向酯化完成后,卸下的烧瓶中加入25mL水的作用是_____ ___ _ __;A装置中固体Na2CO3作用是_______ __。
(4)步骤E的操作要领是 。
(5)装置A的分液漏斗中液体分为两层,苯甲酸甲酯应在 (填上、下)层;B装置蒸馏时,接收苯甲酸甲酯前(温度<199.6℃)锥形瓶中得到的物质是 。
(Ⅱ)苯甲酸甲酯的皂化反应
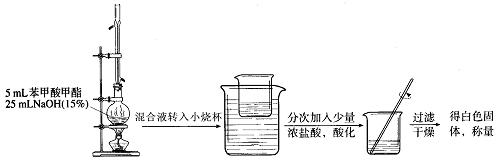
① ② ③
(6)装置①中冷凝管的作用是: ;
能说明①装置中反应完全的现象是_____________。
(7) 在③中得到白色固体的质量为5.9g。假设反应(Ⅰ)和反应(Ⅱ)中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,其它步骤的转化效率为100%,请计算酯化反应中苯甲酸的转化率,写出简要计算过程:
14 分苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为: 
已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |

铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。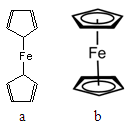
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。

有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如表所示:
|
选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
D
D
D
C
A
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
A
C
B
A
D
B
C
B
D
21.(1)24FeSO4+30HNO3→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)FeSO4 +5价N (3) 得到 4
22.(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-  H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
 (2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
23.(1) 0.01mol/L. min
(2) a=0.05 mol/L 图象如右
(3) BD
24.(1)Br2 ;Fe3+
(2)
乙 同学正确
选用试剂
实验现象
第一种方法
C
有机层无色
第二种方法
D
溶液变红
(3)Fe2+;不可以,因为Br2和Fe3+都能把I―氧化成I2
25.(1)b;
(2)将亚铁离子氧化为铁离子;
(3)除去过量的硫酸;不引入新的杂质;
(4)Fe3++3H2O=Fe(OH)3↓+3H+;(条件:加热)
(5)抑制Cu2+的水解;产生污染环境的二氧化硫,硫酸利用率低;加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)
 26.
26. ⑴ C6H5-CH-18OH CH3CH2- -18OH
⑴ C6H5-CH-18OH CH3CH2- -18OH

 ⑵C6H5-CH-18OH+HCOOH
⑵C6H5-CH-18OH+HCOOH HCO18O-CH-C6H5+H2O
HCO18O-CH-C6H5+H2O
⑶

计算题
27.(1)0.8mol/L (2)29.6%
附加题
1.B
2.C
3.(1)除去混在氢气中的酸性气体
(2)A B、C; 将E中的产生的硫酸亚铁溶液压入D中
(3)②
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com