
题目列表(包括答案和解析)
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 试剂1 | 试剂2温度(℃) | 溶解后温度(℃) |
| 0.5g NaHCO3固体 | 10mL水 19.0 | 18.4 |
| 0.5 g Na2CO3固体 | 10mL水 19.0 | 25.5 |
| 试剂1/温度(℃) | 试剂2/温度(℃) | 恰好反应后温度(℃) |
| 含0.5g NaHCO3固体的饱和溶液/19.0 | 6mL稀盐酸/19.0 | 18.3 |
| 含0.5 g Na2CO3固体的饱和溶液/19.0 | 9mL稀盐酸/19.0 | 22.1 |
- 4 |

(1)门捷列夫的突出贡献是( )
A.提出了原子学说 B.提出了分子学说
C.发现元素周期律 D.发现能量守恒定律
(2)该表变化表明( )
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.ⅠA族元素的金属性比同周期ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从ⅢA族的硼到ⅦA族的砹连接的一条折线,我们能从分界线附近找到( )
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子![]() ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
A.这种原子的中子数为167 B.它位于元素周期表中第6周期
C.这种元素一定是金属元素 D.这种元素的原子易与氢化合
 ,其PRM谱中有2个信号峰,其强度之比为3∶1。
,其PRM谱中有2个信号峰,其强度之比为3∶1。现有分子式均为C2H4O2的两种链状分子组成的混合物,如果在PMR谱上观察到氢原子给出的信号峰有两种情况:第一种情况峰的强度之比为3∶1,第二种情况峰的强度之比为2∶1∶1。由此推断该混合物的组成可能是(写结构简式):
①___________和___________;②___________和___________。
(2)A、B两种有机物均由C、H、O、N四种元素组成,且分子中都含有苯环,A是天然蛋白质的水解产物。A中含氧元素的质量分数为19.4%。A有如下转化关系(均为完全反应):
![]()
①光谱测定显示,A分子结构不存在甲基,A的结构简式为:_____________________;
②B是A的同分异构体,它是苯的某种同系物经硝化反应后的唯一产物,B的结构简式为____________。

①试管中(填产生沉淀或气体及反应速率等相关现象)__________________________。
②盛_____________的试管中气球变得更大,大小气球(包含试管)体积之比约为(填最简单整数比)_____________。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
![]() (aq)+H+(aq)====H2O(l)+CO2(g);ΔH>0
(aq)+H+(aq)====H2O(l)+CO2(g);ΔH>0
![]() (aq)+2H+(aq)====H2O(l)+CO2(g);ΔH<0
(aq)+2H+(aq)====H2O(l)+CO2(g);ΔH<0
甲下结论的方法是否正确?_______________(填“正确”或“不正确”)。
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
① | 35 mL水 | |||
② | 35 mL水 | |||
③ | 35 mL稀盐酸 | 含 | ||
④ | 35 mL稀盐酸 | 含 | ||
⑤ | 35 mL稀盐酸 | |||
⑥ | 35 mL稀盐酸 |
请你帮助填写相关内容:
①该研究报告的题目是《______________________________________________》。
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为___________和___________;通过上述实验可得出五条结论:
a.NaHCO3的溶解是___________(“吸热”或“放热”)过程;
b.Na2CO3的溶解是___________(“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是___________(“吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是___________(“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是___________(填a→d的字母)的热效应之和。
选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
D
D
D
C
A
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
A
C
B
A
D
B
C
B
D
21.(1)24FeSO4+30HNO3→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)FeSO4 +5价N (3) 得到 4
22.(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-  H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
 (2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
23.(1) 0.01mol/L. min
(2) a=0.05 mol/L 图象如右
(3) BD
24.(1)Br2 ;Fe3+
(2)
乙 同学正确
选用试剂
实验现象
第一种方法
C
有机层无色
第二种方法
D
溶液变红
(3)Fe2+;不可以,因为Br2和Fe3+都能把I―氧化成I2
25.(1)b;
(2)将亚铁离子氧化为铁离子;
(3)除去过量的硫酸;不引入新的杂质;
(4)Fe3++3H2O=Fe(OH)3↓+3H+;(条件:加热)
(5)抑制Cu2+的水解;产生污染环境的二氧化硫,硫酸利用率低;加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)
 26.
26. ⑴ C6H5-CH-18OH CH3CH2- -18OH
⑴ C6H5-CH-18OH CH3CH2- -18OH

 ⑵C6H5-CH-18OH+HCOOH
⑵C6H5-CH-18OH+HCOOH HCO18O-CH-C6H5+H2O
HCO18O-CH-C6H5+H2O
⑶

计算题
27.(1)0.8mol/L (2)29.6%
附加题
1.B
2.C
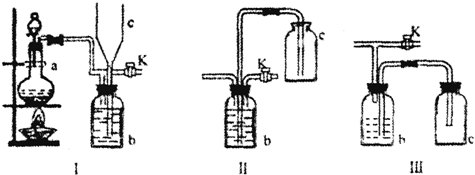
3.(1)除去混在氢气中的酸性气体
(2)A B、C; 将E中的产生的硫酸亚铁溶液压入D中
(3)②
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com