
题目列表(包括答案和解析)
本题有I和II两小题。
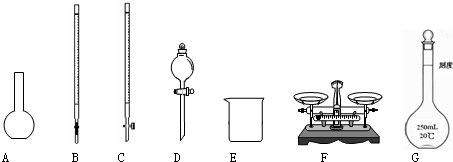
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是__________(填写编号)。
(2)能够用以精确量取液体体积的是_______(填写编号)。
(3)由于操作错误,使得到的数据比正确数据偏小的是________(填写编号)。
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(4)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_________g。
(5)有下列实验:
①苯与溴的取代反应 ②苯的硝化反应
③乙醛的银镜反应 ④测定一定温度下KNO3的溶解度
⑤乙酸乙酯的制取 ⑥石油分馏实验
其中需要使用温度计的有___________(填写编号)
Ⅱ.某种胃药片的制酸剂为碳酸钙,其中所含的CaCO3质量的测定如下:
①需配制0.1 mol/L的HCl和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20.00 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去V mL达滴定终点;
④加入25.00 mL 0.1 mol/L的HCl溶液。
(1)写出实验步骤(写编号顺序)___________________________。
(2)在下图所示的仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液肯定不需要的仪器是(填序号)________,配制上述溶液还需要的玻璃仪器是(填仪器名称)_________________________。

(3)配制上述溶液应选用的容量瓶规格是_________(填字母)。
A.50 mL 50 mL B.100 mL 100 mL
C.100 mL 150 mL D.250 mL 250 mL
(4)写出有关的化学方程式______________。
(5)每片胃药中含碳酸钙的质量是____________________g。
I、配制480 mL 0、3mol/L NaOH溶液。具体如下:
(1)需 gNaOH。
(2)配制过程中,下列仪器不会用到的是_____________,尚缺少的玻璃仪器是______________。
A.托盘天平 B.250mL容量瓶 C.玻璃棒 D.胶头滴管
(3) 实验过程中两次用到玻璃棒,其作用分别是:_____________________、_________________________。
(4) 定容操作:将蒸馏水注入所选的容器中,直到其中液面接近其刻度线
处时,改用 滴加蒸馏水至溶液的 正好与刻度线 。将瓶塞子盖好,反复 摇匀。
(5)下列操作的正确顺序是(用字母表示) B→ → → → → →G 。
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.转移 G.摇匀
II、乙同学用18.4mol/l浓硫酸配制100ml 3.6mol/L的稀硫酸。
用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处
。
III、在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,容量瓶中有少量水。______________。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线____________。
(4) 转移时不慎将溶液倒在瓶外; ;
(5)定容时俯视容量瓶刻度线: 。
(W2-W1)g×
| ||||
| a g |
(W2-W1)g×
| ||||
| a g |



| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com