
题目列表(包括答案和解析)

| ||


 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
某兴趣小组的同学探究浓硫酸与铁定(碳素钢)反应后产生气体的成分。
【查阅资料】①Fe与浓H2SO4反应,加热,有SO2生成
②C与浓H2SO4反应,加热,有CO2和SO2生成
③SO2可使澄清石灰水变浑浊
④SO2可使品红溶液的红色褪去,而CO2不能
⑤SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能
⑥碱石灰的主要成分为NaOH和Cao
【实验探究】
 (1)称取24.0g铁钉放入60.0mL浓硫酸中,加热,充分反应后得到的溶液X并收集到气体Y。甲同学通过实验测定并推知气体Y中SO2气体的体积分数为66.7%。同学们认为气体Y中还可能还有H2和Z气体,则Z气体可能是 。探究实验的主要装置如下图所示:
(1)称取24.0g铁钉放入60.0mL浓硫酸中,加热,充分反应后得到的溶液X并收集到气体Y。甲同学通过实验测定并推知气体Y中SO2气体的体积分数为66.7%。同学们认为气体Y中还可能还有H2和Z气体,则Z气体可能是 。探究实验的主要装置如下图所示:
 (2)装置A中试剂的作用是 。[来源:学_科_网Z_X_X_K]
(2)装置A中试剂的作用是 。[来源:学_科_网Z_X_X_K]
(3)为确认Z的存在,需要将装置甲(如右图所示)接入上述装置的(填编号) 之间。装置甲中的液体名称是 。
(4)实验中,如果观察到装置D中 ,且装置E中 ,则可确认Y中还有H2气体。
(5)如果需要测定限定体积气体Y中H2的含量(H2约为0.01g)。除可用测量H2体积方法外, (选填:“能”或“不能”)用称量上图中装置D、装置E的质量变化的方法,通过计算说明你判断的理由。
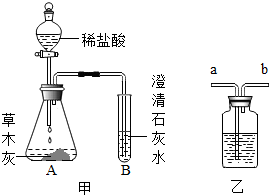 (2013?揭东县一模)小云同学在整理厨房时不小心将一瓶醋打翻,醋洒在火炉旁的一堆草木灰上,发现有大量的气泡生成.激发了兴趣,于是他决定与学习小组的同学,对草木灰的成分进行探究.
(2013?揭东县一模)小云同学在整理厨房时不小心将一瓶醋打翻,醋洒在火炉旁的一堆草木灰上,发现有大量的气泡生成.激发了兴趣,于是他决定与学习小组的同学,对草木灰的成分进行探究.
| ||
| ||
| 化合物所含金属元素 | 钙元素 | 钾元素 | 铜元素 | … |
| 灼烧产生火焰颜色 | 砖红色 | 紫色(透过蓝色钴玻璃片) | 绿色 | … |


一、选择题(本大题包括14小题,1-8题每小题2分,9-14小题每小题3分,共34分)。
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
B
A
D
D
C
C
D
B
D
A
B
A
C
B
二、填空题(本题包括5小题,共26分)。
15.(每空1分,共4分)(1)①2H;② 2SO/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image060.gif) ;(2)①两个甲烷分子
;(2)①两个甲烷分子
②每个甲烷分子中含有四个氢原子
16.(每空1分,共6分)(1)④;(2)③;(3)①;(4)⑤;(5)⑥;(6)②。
17.(每空1分,共6分)(1)x=11,y=6;(2)Na;(3)O2-;(4)③和④;
(5)Na2SO4或NaOH或H2SO4。
18.(化学方程式2分外,其余每空1分,共6分)。(1)吸附,不是
(2)/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image062.gif) +2
+2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image024.gif) =
=/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image065.gif) +
+/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image067.gif) +
+/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image069.gif) (化学方程式化学式错误不得分,没配平扣1分,没有标明反应条件、生成物状态扣1分,以下化学方程式评分按这标准)。(3)肥皂水(4)一水多用(或工业上循环用水,农业浇灌改浸灌为喷灌)(其它合理答案,同样给分)
(化学方程式化学式错误不得分,没配平扣1分,没有标明反应条件、生成物状态扣1分,以下化学方程式评分按这标准)。(3)肥皂水(4)一水多用(或工业上循环用水,农业浇灌改浸灌为喷灌)(其它合理答案,同样给分)
19.(化学方程式2分外,其余每空1分,共6分)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image070.gif)
(1)CH4+2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image039.gif) 2H2O+CO2(2)硫化氢。(3)空气(或氧气)。
2H2O+CO2(2)硫化氢。(3)空气(或氧气)。
三、综合能力题(本题包括2小题,共20分)。
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image072.gif)
20.(1)/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image074.gif) (2分) (2)4P+5
(2分) (2)4P+5/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image039.gif) 2
2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image077.gif) (2分)
(2分)
(3)分子是不断运动着,吸热(每空1分)(4)氮气,二氧化碳(每空1分)
21.(化学方程式每个2分,其余每空2分,共12分)
(1)甲:/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image079.gif) 乙:C 丙:
乙:C 丙:/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image081.gif)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image082.gif)
(2)①2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image084.gif) 2
2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image086.gif)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image088.gif)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image089.gif) |
②2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image069.gif) 2
2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image092.gif) +
+/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image094.gif)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image095.gif) |
③/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image081.gif) +CO
+CO /汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image098.gif) +
+/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image100.gif)
四、实验探究题(本题包括2小题,共24分)。
22.(化学方程式每个2分,特别标明分值外,其余每空1分,共14分)
(1)a:试管b:长颈漏斗;酒精灯不用时没有盖上灯帽致灯心留有水份。
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image101.gif) |
(2)2KMnO4 K2MnO4+MnO2+O2↑,试管口没有塞一小团棉花,造成高锰酸钾
粉末通过导管进入水槽;(3)BEF(或AEF)(2分选漏1个扣1分,选错1个得0分),
CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)使二氧化碳与水隔离,防止二氧化碳溶于水,没有;(5)②,③。
23.(每空2分,共10分)
【实验验证】实验一 :/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image084.gif) 溶液常温下缓慢分解
溶液常温下缓慢分解
实验二 :/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image104.gif) 能加快
能加快/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image084.gif) 的分解速率
的分解速率
实验三 :反应后/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image104.gif) 质量不变
质量不变
【反思评价】反应前后/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image104.gif) 化学性质是否改变
化学性质是否改变
【拓展】相同条件下,二氧化锰的催化效果优于三氧化二铁(其它合理答案,同样给分)
五、计算题(本题包括2小题,共16分)
24.(6分)(1)(3分)Ca(1分) 40 : 71 : 32(2分) (2)(2分)49.7% (3)(1分)100
25.(10分)(1)增大石灰石与盐酸的接触面积,加快反应速率。 ……(2分)
(2)2.2 ……(2分)
(3)解:设石灰石样品中碳酸钙的质量为x
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image109.gif) + 2
+ 2/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image111.gif) =
=/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image113.gif) +H2O+
+H2O+/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image115.gif)
100 44
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image117.gif)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image119.gif) ……(2分)
……(2分)
/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image121.gif) g
g
石灰石样品中碳酸钙的质量分数=/汕头市濠江区九年级2008~2009学年度第-学期期终教学质量检查化学试题.files/image123.gif) =83.3% ……(2分)
=83.3% ……(2分)
答:(略)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com