
题目列表(包括答案和解析)
(Ⅰ)某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)
操作Ⅱ必须用到的仪器是________.(填编号)
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式___________________,
加入氨水要过量的原因是__________________________.
(3)检验沉淀是否已经洗涤干净的操作是_____________________________
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是________________________.
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是________(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是________________________________.(写出一种原因即可).
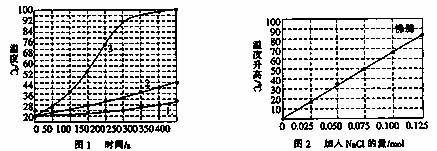
(Ⅱ)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量.下面是在形同的室温下对该产品的两个探究实验:
实验1:向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1.
①1.0 mol镁条、0.10 mol铁粉、0.10 mil氯化钠粉末;
②将1.0 mol镁条剪成100份、0.10 mol铁粉、0.10 mil氯化钠粉末;
③1.0 mol镁粉、0.10 mol铁粉、0.10 mil氯化钠粉末;

实验2:向加有100 mL水的隔热容器中分别加入0.10 mol镁粉、0.50 mol铁粉及不同量的氯化钠粉末,不断搅拌,第15 min时记录温度升高的幅度参见上图2.
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是________.
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是__________.
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060 mol NaCl,则第15 min时混合物的温度最接近于________.
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是______________________________________.
士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在形同的室温下对该产品的两个探究实验:
【实验1】向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mil氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mil氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mil氯化钠粉末;
【实验2】向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是 。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是 。
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060molNaCl,则第15min时混合物的温度最接近于 。A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com