
题目列表(包括答案和解析)
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。
(1)在O〜30小时内,CH4的平均生成速率和
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热分别为
和
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g) CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
①2700C的实验结果所对应的曲线是_________(填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________(填字母)。
A. 1 〜1.5 B. 2. 5〜3 C. 3. 5〜4. 5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l)H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
(15分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为 ;
Ⅱ.已知:
H2O(g)=H2(g)+ O2(g) △H1 = +242 kJ·mol-1
Mg(s)+2 H2O(g)=Mg(OH)2(s) + H2(g) △H2 = -441 kJ·mol-1
Mg(s)+ O2(g)=MgO(s) △H3= -602kJ·mol-1
(2)氢氧化镁分解的热化学方程式为 ;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁。
(3)步骤①中加入保险粉的作用: 。
(4)已知EDTA只能与溶液中的反应生成易溶于水的物质,不与
反应。虽然
难溶于水,但步骤②中随着EDTA的加入,最终能够将
除去并获得纯度高的
。请从沉淀溶解平衡的角度加以解释 ;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母)。
①40℃ ②60℃ ③EDTA质量为O.05g
④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)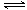 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)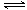 H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l)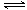 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示: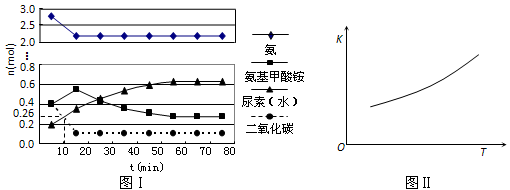
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com