黄铜矿(CuFeS
2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为8CuFeS
2+21O
2 8Cu+4FeO+2Fe
2O
3+16SO
2若CuFeS
2中Fe的化合价为+2,反应中被还原的元素是
Cu、O
Cu、O
(填元素符号).
(2)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
AD
AD
(填字母).
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
| B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
| C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
| D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
(3)过二硫酸钾(K
2S
2O
8)具有强氧化性,可将I
-氧化为I
2:S
2O
82-+2I
-=2SO
42-+I
2通过改变反应途径,Fe
3+、Fe
2+均可催化上述反应.试用离子方程式表示Fe
3+对上述反应的催化过程.
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
、
S2O82-+2Fe2+=2SO42-+2Fe3+
S2O82-+2Fe2+=2SO42-+2Fe3+
(不必配平).
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe
2O
3、FeO、SiO
2、AI
2O
3)可制备Fe
2O
3.方法为
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得.
据以上信息回答下列问题:
a.除去AI
2O
3的离子方程式是
6H++AI2O3=3H2O+2Al3+、Al3++4OH-=2H2O+AlO2-
6H++AI2O3=3H2O+2Al3+、Al3++4OH-=2H2O+AlO2-
.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO
4溶液 NaOH溶液 碘水
所选试剂为
稀硫酸、KMnO4溶液
稀硫酸、KMnO4溶液
.证明炉渣中含有的实验现象为
稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
.

 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。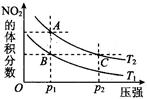
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。

 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2