
题目列表(包括答案和解析)
某实验小组查阅资料得知:
5C2O42—+2MnO4—+16H+====10CO2↑+2Mn2++8H2O
欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。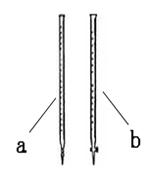
(1)滴定时用______(填a或b)。
(2)滴定管盛装KMnO4标准溶液。滴定前______(填“是”或“否”)滴加指示剂,滴定终点的现象是____________________。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为______________。
将过量的金属锌投入到含0.200 mol H2SO4的热浓硫酸中,下列判断正确的是 ( )
| A.因发生“钝化”而不反应 | B.产生的SO2为0.100 mol |
| C.产生的SO2少于0.100 mol | D.除SO2外还会有H2产生 |
(8分)某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。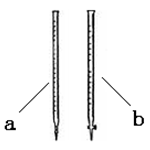
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
将过量的金属锌投入到含0.200 mol H2SO4的热浓硫酸中,下列判断正确的是( )
A.因发生“钝化”而不反应 B.产生的SO2为0.100 mol
C.产生的SO2少于0.100 mol D.除SO2外还会有H2产生
用中和滴定法测定某烧碱的纯度。
(1)配制待测液
将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要仪器有________________________________________________________________________
________________________________________________________________________。
(2)滴定
①盛装0.200 mol·L-1盐酸标准液应该用__________式滴定管,盛装前对滴定管的要求是:________________________________________________________________________
________________________________________________________________________。
②滴定时,应先向锥形瓶中加________滴__________作指示剂;滴定过程中两眼应注视________________________,当_______________________________时为滴定终点。
③有关数据记录如下:
|
滴定序号 |
待测液体体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
① |
20.00 |
0.50 |
20.70 |
|
② |
20.00 |
6.00 |
26.00 |
(3)纯度计算
NaOH溶液的浓度为__________mol·L-1,烧碱样品的纯度为__________。
(4)对几种假定情况的讨论
①若用蒸馏水冲洗锥形瓶,则会使测定结果______;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果__________;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________。(以上均填“偏低”、“偏高”或“无影响”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com