
题目列表(包括答案和解析)
A、c(N
| ||
| B、c(NH3?H2O)+c(OH-)=c(H+) | ||
C、c(Cl-)>c(N
| ||
D、c(N
|
|
常温下,氨水的pH=x,某盐酸的pH=y,x+y=14且x>11.将上述氨水和盐酸等体积混合后,所得溶液中各离子的浓度的关系正确的是 | |
| [ ] | |
A. |
c(Cl-)>c(NH |
B. |
c(NH |
C. |
c(Cl-)>c(NH |
D. |
c(NH |
|
常温下,某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11.将上述氨水和盐酸等体积混合后,所得溶液各离子的浓度关系正确的是 | |
| [ ] | |
A. |
c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
B. |
c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
C. |
c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
D. |
c(NH4+)>c(Cl-)>c(H+)>c(OH-) |


| ||
| ||
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。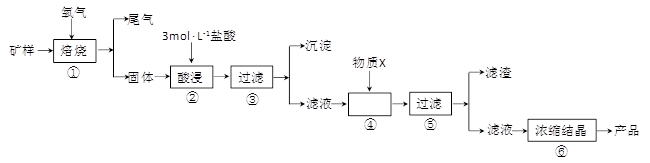
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

1―5ADCCA 6―10DABBC 11―15BCABB 16―20BCDBD
第II卷(共50分)
21.NH3 NO HCl O2 H2
22.(1)略 三角锥
(2)略 H2O2+SO2=H2SO4 4OH-―4e=2H2O+O2
(3)根据液面上升的速率不同区分,氨气的溶解度大于二氧化硫,液面上升的速率
(4)C(OH-) C(SO42-) C(NH4+) C(OH-)
23.(1) bd
(2)①25% 23.1 ②>
(3)阴 N2+6e-+6H-=2NH3
24.(1)Al2O3 H2

|