
题目列表(包括答案和解析)
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。

图中t1时引起平衡移动的条件可能是 __ , t3时引起平衡移动的条件可能是 __ ___ , 其中表示平衡混合物 中NH3的含量最高的一段时间是 。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、 H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。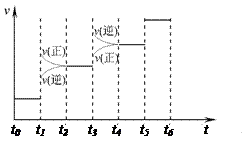
图中t1时引起平衡移动的条件可能是 __ , t3时引起平衡移动的条件可能是 __ ___ , 其中表示平衡混合物中NH3的含量最高的一段时间是 。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。

图中t1时引起平衡移动的条件可能是 __ , t3时引起平衡移动的条件可能是 __ ___ , 其中表示平衡混合物 中NH3的含量最高的一段时间是 。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答: H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。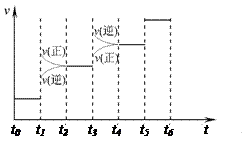
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
1―5ADCCA 6―10DABBC 11―15BCABB 16―20BCDBD
第II卷(共50分)
21.NH3 NO HCl O2 H2
22.(1)略 三角锥
(2)略 H2O2+SO2=H2SO4 4OH-―4e=2H2O+O2
(3)根据液面上升的速率不同区分,氨气的溶解度大于二氧化硫,液面上升的速率
(4)C(OH-) C(SO42-) C(NH4+) C(OH-)
23.(1) bd
(2)①25% 23.1 ②>
(3)阴 N2+6e-+6H-=2NH3
24.(1)Al2O3 H2

|