
题目列表(包括答案和解析)
下列叙述正确的是( )w.w.w.k.s.5.u.c.o.m
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
(化学-物质结构与性质)![]()
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
![]() C和Si元素在化学中占有极其重要的地位。
C和Si元素在化学中占有极其重要的地位。
![]() (1)写出Si的基态原子核外电子排布式 。
(1)写出Si的基态原子核外电子排布式 。
![]() 从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
![]() (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
![]() (3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
![]() (4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成![]() 键和
键和![]() 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述![]() 健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述![]() 键 。
键 。
甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。 w_w w. k#s5_u.c o*m
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳: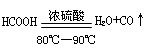 ,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。

①从下图挑选所需的容器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、
胶皮管,固定装置不用画)w_w*w.k*s 5*u.c*o m
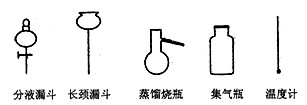
②装置Ⅱ的作用是______________________________________________。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4NaHCO3==Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+5H2O==2Cu(HCOO)2·4H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
③步骤i是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是__________________________________________。w_w*w.k*s 5*u.c*o m
④步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70~80℃,如果看到_____________________(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是_______________________________。
⑥用乙醇洗涤晶体的目的是________________________________。
![]() Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
![]() ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素;
![]() ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn
![]() ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数;
![]() ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。
![]() 请回答下列问题:
请回答下列问题: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
![]() (1)Z2+ 的核外电子排布式是 。
(1)Z2+ 的核外电子排布式是 。
![]() (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
![]() (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
![]() a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
![]() c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
![]() (4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
![]() (5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
![]() (6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。下图是北京鸟巢试放烟火奥运五环图,并回答下列问题:w.w.w.k.s.5.u.c.o.m

(1)火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”变化。)
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体且发现只有氯元素的化合价发生变化。请写出该反应的方程式
(3)下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为![]() ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:

①B的水溶液呈弱酸性,其主要的电离方程式可表示为__________________,D的化学式是_________。
②A、B、E中均含有的一种元素符号为______________。
③C与纯碱反应的化学方程式为____________________。
④液态B与液态E反应可生成一种单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com