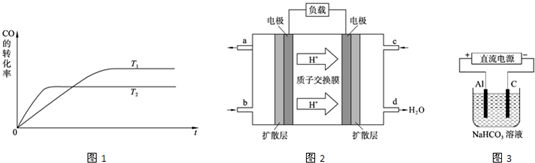
(2011?金台区模拟)I、图1各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:
(1)甲的俗名是
小苏打
小苏打
.
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,说明溶液均显
碱性
碱性
性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:
不同,A溶液显碱性是因为碳酸根离子发生水解,CO32-+H2O?HCO3-+OH-,D溶液显碱性是因为:NH3?H2O?NH4++OH-
不同,A溶液显碱性是因为碳酸根离子发生水解,CO32-+H2O?HCO3-+OH-,D溶液显碱性是因为:NH3?H2O?NH4++OH-
.
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方程式:
NaCl+NH3+CO2+H2O=NaCO3+NH4Cl
NaCl+NH3+CO2+H2O=NaCO3+NH4Cl
.
II、甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H
2(g)→CH
3OH(g).
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=
.
②下列各项中,不能够说明该反应已达到平衡的是
d
d
(填序号).
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH
3OH分解的速率和CH
3OH生成的速率相等
c.一定条件下,CO、H
2和CH
3OH的浓度保持不变
d.一定条件下,单位时间内消耗2mol CO,同时生成1mol CH
3OH
(2)图2是该反应在不同温度下CO的转化率随时间变化的曲线.
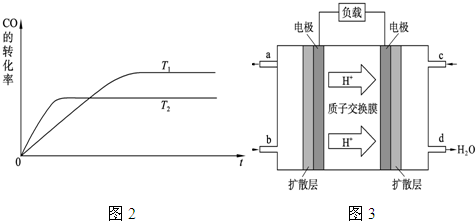
①该反应的焓变△H
<
<
0(填“>”、“<”或“=”).
②T
1和T
2温度下的平衡常数大小关系是K
1>
>
K
2(填“>”、“<”或“=”).
③若容器容积不变,下列措施可增加甲醇产率的是
b
b
.
a.升高温度
b.将CH
3OH(g)从体系中分离
c.使用合适的催化剂d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(g)△H=-a kJ?mol
-1②2CO(g)+O
2(g)=2CO
2(g)△H=-b kJ?mol
-1③H
2O(g)=H
2O(l)△H=-c kJ?mol
-1
则CH
3OH(l)+O
2(g)=CO(g)+2H
2O(l)△H=
kJ?mol
-1.
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图3所示.
①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,c口通入的物质为
O2
O2
.
②该电池正极的电极反应式为:
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
.