
题目列表(包括答案和解析)
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |

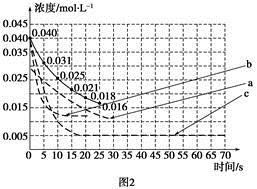
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
 CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
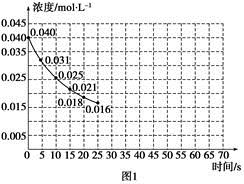
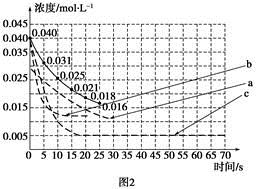
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+ O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②中的能量变化如下图所示 |

 CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如下图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如下图所示。下列叙述中正确的是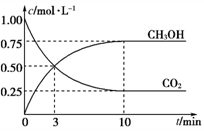
已知:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如下图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如下图所示。下列叙述中正确的是
A. 欲增大平衡状态时c(CH3OH)/ c(CO2)的比值,可采用升高温度的方法
B. 3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C. 欲提高H2的平衡转化率只能加压减小反应容器的体积
D. 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1

高三化学
第I卷(选择题,共48分)
一.选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
B
C
D
C
A
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
B
A
C
D
C
B
A
A
题号
21
22
23
24
答案
B
B
C
D
第II卷(共52分)
二.简答题(本大题包括5小题,共45分。)
【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
25.(A题,8分)(1)画出金属元素与非金属元素的分界线(2分)
Na
Cl
(2) IVA 族。(1分,其他答案均不给分)
(3)①见表中“Na”和“Cl”(各1分,写成名称或位置写错均不给分)。
② 氯 (填名称,1分),化学反应方程式 Cl2+H2S=2HCl+S(2分,其他合理答案也给分) 。
25.(B题,8分)
Mg
Al
|