
题目列表(包括答案和解析)
下列叙述中,正确的是
![]() A.10ml0.1mol/L醋酸中加入几滴1mol/L H2SO4后,c(CH3COOH)/c(H+)变大
A.10ml0.1mol/L醋酸中加入几滴1mol/L H2SO4后,c(CH3COOH)/c(H+)变大
![]() B.将0.2mol/L HCN和0.1mol/L NaOH等体积混合后:c(HCN)+c(CN-)=2c(Na+)
B.将0.2mol/L HCN和0.1mol/L NaOH等体积混合后:c(HCN)+c(CN-)=2c(Na+)
![]() C.将20 ml 0.4mol/L硝酸铵溶液跟50 ml 0.1 mol/L氢氧化钡溶液混合:c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
C.将20 ml 0.4mol/L硝酸铵溶液跟50 ml 0.1 mol/L氢氧化钡溶液混合:c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
D.0.5mol/L的下列溶液中 ①NH3?H2O ②NH4Cl ③NH4HCO3 ④(NH4)2SO4,c(NH4+):④>②>③>①
下列说法正确的是( )
A.常温下,在pH<7的酸性溶液中,不可能存在NH3?H2O
B.常温下.在pH=7的NH4Cl和NH3?H2O的混合液中。c(NH4+)=(Cl-)
C.将等物质的量的NH4Cl和NH3?H2O溶于水配成溶液.则溶液中c(NH4+)<(Cl-)
D.在0.1moL/L的K2S溶液中:c(K+)=c(S2-)+c(HS-)+c(H2S)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。

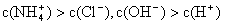

 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va :Vb= 。
(6)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
(12分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ __。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ 和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH多0.05mol。
(4)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是.
Mg(OH)2(固) ![]() Mg2++2OH-……①
Mg2++2OH-……①
NH4++H2O ![]() NH3?H2O+H+……②
NH3?H2O+H+……②
H++![]() H2O……③
H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是.
Mg(OH)2(固) ![]() Mg2++2OH-……① NH4++
Mg2++2OH-……① NH4++![]() NH3?H2O……②
NH3?H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3?H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
①丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂加入Mg(OH)2悬浊液中,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3?H2O
②丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2溶解的离子方程式___________________。
高三化学
第I卷(选择题,共48分)
一.选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
B
C
D
C
A
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
B
A
C
D
C
B
A
A
题号
21
22
23
24
答案
B
B
C
D
第II卷(共52分)
二.简答题(本大题包括5小题,共45分。)
【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
25.(A题,8分)(1)画出金属元素与非金属元素的分界线(2分)
Na
Cl
(2) IVA 族。(1分,其他答案均不给分)
(3)①见表中“Na”和“Cl”(各1分,写成名称或位置写错均不给分)。
② 氯 (填名称,1分),化学反应方程式 Cl2+H2S=2HCl+S(2分,其他合理答案也给分) 。
25.(B题,8分)
Mg
Al
|