
题目列表(包括答案和解析)
(7分)(1)用的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
====
△H=+64kJ/mol
====
△H= -196kJ/mol
====
△H= -286kJ/mol
在溶液中
与
反应生成
和
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅和3.0 mol/L的
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
|
| ( |
|
|
|
|
|
|
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的溶液中加入一定量的
和
溶液,加热,生成
沉淀。制备
的离子方程式是 。
(7分)(1)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: ====
==== △H=+64kJ/mol
△H=+64kJ/mol
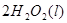 ====
==== △H= -196kJ/mol
△H= -196kJ/mol
 ====
==== 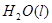 △H= -286kJ/mol
△H= -286kJ/mol
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为
。
的热化学方程式为
。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0 mol/L的
和3.0 mol/L的 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温 度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
|
|
( |
|
|
|
|
|
|
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的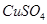 溶液中加入一定量的
溶液中加入一定量的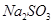 和
和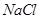 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
 H2(g)+CO2(g)的平衡常数随温度的变化如下表
H2(g)+CO2(g)的平衡常数随温度的变化如下表
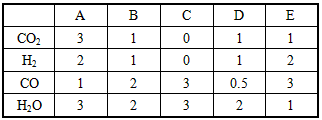
 HCO3-+H+的平衡常数K1=___________。
HCO3-+H+的平衡常数K1=___________。| 1.1 |
 ≈1)
≈1)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com