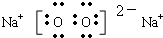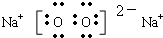现有六种元素A、B、C、D、E均为周期表中前18号元素,且原子序数依次增大.已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物.D元素的原子半径是短周期主族元素中最大的;E元素是地壳中含量最高的金属.请回答以下问题:
(1)请画出D的离子结构示意图
;由C、A两种元素形成的18电子化合物的电子式为
;
(2)E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式:
Al2O3+2OH-=2AlO-2+H2O
Al2O3+2OH-=2AlO-2+H2O
;
(3)由以上五种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有
Na2O2
Na2O2
(填化学式);它的主要用途是
供氧剂、漂白剂
供氧剂、漂白剂
,它与水反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.