
题目列表(包括答案和解析)
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |

影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。
甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol·L-1的硫酸于试管中 ②____________ |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
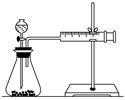
(1)甲同学表中实验步骤②为____________________________。
(2)甲同学的实验目的是____________________________________________________
________________________________________________________________________;
要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是
________________________________________________________________________
________________________________________________________________________。
(4)乙同学完成该实验应选用的实验药品是____________
________________________________________________________________________,
该实验中不选用某浓度的硫酸,理由是______________________________________
________________________________________________________________________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰
C.二氯化锰 D.水
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
|
序号 |
条件 |
现象 |
结论 |
|
|
温度/℃ |
催化剂 |
|||
|
1 |
40 |
FeCl3溶液 |
|
|
|
2 |
20 |
FeCl3溶液 |
|
|
|
3 |
20 |
MnO2 |
|
|
|
4 |
20 |
无 |
|
|
试回答:
①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________。
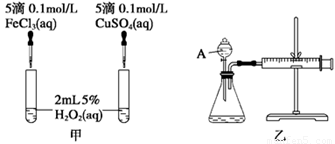
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(16分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | | 反应物浓度越大,反应速率越快 |
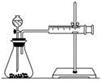
(16分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | | 反应物浓度越大,反应速率越快 |
第Ⅰ卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
答案
C
B
C
B
C
A
B
题号
8
9
10
11
12
13
14
答案
C
A
C
D
B
A
C
第Ⅱ卷(共58分)
二、填空题(本题包括4小题,共48分)
15.(13分)
(1)①增大(1分)
②增大 减小(各1分,共2分)
③E(1分)
④t3~t5(1分)
⑤D B(各1分,共2分)
⑥
(2)2NH3+60H--6e-===N2+6H2O(2分) 碱性(1分)
NH3在酸性介质中易转化为NH4+离子(1分)
16.(12分)
(1)第二周期 第VA族(各0.5分共1分)
(2)NH3+H+===NH4+(或H2O+H+===H3O+)(2分)
(3)Al3++3H2O Al(OH)3+3H+(2分)
Al(OH)3+3H+(2分)
(4)NaOH; NH4NO3(各1分共2分)
(5)2H2-4e-+4OH===4H2O(2分)
(6)①A(1分)
②0.25mol2?L-2(或0.25)(2分)
17.(9分)
(1)①吸收CO2中的水蒸汽(或干燥CO2气体)(1分)
②防止空气中的二氧化碳和水蒸汽进入C中(1分)
③C(1分)
(2)①NaOH溶液(1分)
②过滤(1分) 干燥(1分)
③ (2分)
(2分)
(3)方案一中的CO2气体不能完全被装置C中的碱石灰吸收(1分)
18.(14分)
(1)离子键、共价键(或非极性键)(各0.5分共1分)
0.2NA 或1.024×1023 (1分)
(2)Cl2+2OH-===Cl- + ClO- +H2O(2分)
(3)C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O(2分)
(4)NH4++HCO3-+2OH-△NH3↑+CO32-+2H2O(2分)
(或:NH4++HSO3-+2OH-△NH3↑+SO32-+2H2O,
(或:NH4++HS-+2OH-△NH3↑+S2-+2H2O,其它正确答案亦可)
(5)4HCl+NaAlO2===NaCl+AlCl3+2H2O(2分)
(或:4H2SO4+2NaAlO2===Na2SO4+Al2(SO4)3+4H2O,若H2SO4写成硝酸亦可)
(6)2NH4Cl+Ca(OH)2△CaCl2 +2H2O+2NH3↑(2分)
4NH3(g)+5O2(g)===4NO(g)+6H2O(g);△H=-906.8KJ/mol(2分)
三、选做题(本题分A、B两题,考生只要选其中一题作答。若两题都作答,则以A题得分计入总分。本题共10分)
(1)Na<Al<Si<N 高
(2)高 NaCl为离子晶体而SiCl4为分子晶体
(3)三角锥形
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) [Cu(NH3)4]2+
(5)Cu3 N
(6)AlN 共价键
19B.(各1分共10分)
(I)
(II)(1)加成反应 消去反应
(2)浓硫酸、加热
(3) 

(4) 银氨溶液[或新制Cu(OH)2悬浊液]
银氨溶液[或新制Cu(OH)2悬浊液]
(5)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com