
题目列表(包括答案和解析)
 下列有关说法中不正确的是
下列有关说法中不正确的是已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
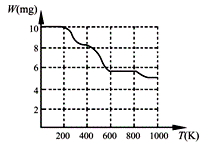 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
一、选择题(共55分)(其中1―5每题2分共10分,6―20每题3分共45分)
1―5 BBCDB 6―10 DBBBA 11―15 BCBAB 16―20 CCCBD
二、填空题
21.(10分)(1)A:碳酸铵或碳酸氢铵(2分)
B:略 D:三角锥 G:红棕色(各1分)
(2)2CO2+2Na2O2=2Na2CO3+O2↑(2分)
(3)4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=+108akJ?mol-1(3分)
(1)4HCl(浓盐酸)+MnO2===MnCl2+2H2O+Cl2↑(2分)
.files/image022.gif) |
(2)2Cl2+2H2O(气)+C====4HCl↑+CO2↑(2分)
吸收Cl2中的HCl气体,提供D处所需水蒸气。(1分)
(3)生成的HCl气体使紫石蕊溶液变红,因未反应完的Cl2与H2O作用产生的HClO的漂白作用使红色消失。(2分)
(4)B(1分)
(5)瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2(2)
23.(11分)(1)0.93<x(Mg)<1.57,2,55<x(N)<3.44。(各2分)
(2)同周期(同主族)中,x值越大,其原子半径越小;(2分)周期性。(1分)
(3)氮原子(1分)
(4)共价键(2分)
(5)第六周期IA族(1分)
24.(9分)(1)正向(1分) (2)B、D(2分)
(3)①n(D)>0.6mol(2分)②n(C)=1.8mol n(D)>0.5mol(各2分)
三、计算题(5分)
26.(1)66.7% (2)50
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com