
题目列表(包括答案和解析)
(12分)在一定条件下,可逆反应A + B![]() mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
⑴温度T1 T2(填大于、等于或小于)
⑵正反应是 反应(填“吸热”或“放热”)
⑶如果A、B、C均为气体,则m 2(填大于、等于或小于)
⑷当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,
则体系的压强 (填增大、减小或不变),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)
22.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)能判断该反应已经达到化学平衡状态的依据是 (多选扣分)。
A、容器中压强不变;B、混合气体中c(CO)不变;C、v正(H2)=v逆(H2O);D、c(CO2)=c(CO)。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃
23. (12分)在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2![]() 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
⑴NO2的转化率为?
⑵反应前后的压强比为多少?
⑶在这5分钟内,用O2来表示的平均反应速率是多少?
Ⅰ.在1 L容器中通入CO2、H2各2 mol,在一定条件下发生反应:CO2+H2![]() CO+H2O,回答下列问题:
CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%.求该条件下平衡常数K1=________.
(2)在(1)的基础上,把体系温度降至800℃.已知该条件下的平衡常数K2=0.81,可以推知该反应的正反应为________反应(填“吸热”、“放热”).
(3)在(1)的基础上,压缩容器体积之0.5 L.该条件下的平衡常数为K3.则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2 mol,n(H2)=1.5 mol,
n(CO)=0.9 mol,n(H2O)=0.9 mol,则此时该反应________进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
Ⅱ.向一容积为1 L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y( s)![]() 2Z(g);ΔH<0.下图是容器中X、Z的物质的量浓度随时间变化的曲线.
2Z(g);ΔH<0.下图是容器中X、Z的物质的量浓度随时间变化的曲线.
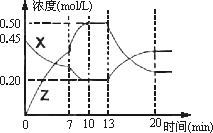
(1)0~10 min容器内气体的压强逐渐________.(填“变大”、“变小”或“无法确定”)
(2)推测在第7 min时曲线变化的原因可能是________第13 min时曲线变化的原因可能是________(填序号)
①增加Z的量
②增加X的量
③升温
④降温
⑤使用催化剂
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5 L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密 闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)
闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。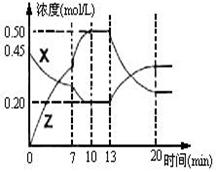
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是  __(填序号)
__(填序号)
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂
(每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。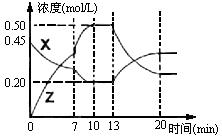
(1)0~10min 容器内气体的压强逐渐 ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
 CO + H2O,
CO + H2O, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
1.C 2.A 3.D 4.C 5.B 6.AC 7.CD 8.C
 9.(18分)
9.(18分)
(1)300
(2) (4分,每空2分)
(4分,每空2分)
(3)①350
②V2,A2
③如图所示(4分,有错不给分,但图中
电压表选 或电流表选
或电流表选 ,不重复扣分)
,不重复扣分)
10.(16分)解:(1)由动能定理得 ①(3分)
①(3分)
得 (2分)
(2分)
(2)在水平滑道上
由动能守恒定律得 ②
②
联解得
(3)设物块 能够上升的最大高度为
能够上升的最大高度为 ,物块
,物块 被弹回过程中由能量守恒定律得
被弹回过程中由能量守恒定律得 ③
③
解得
11.(18分)
解:(1)以 为研究对象,根据平衡条件
为研究对象,根据平衡条件
求出
通过 杆电流方向为由
杆电流方向为由 到
到 (或在图中标出)
(或在图中标出)
(2)根据法拉第电磁感应定律
根据欧姆定律
求出
(3)根据法拉第电磁感应定律

感应电流
根据牛顿第二定律
安培力 
求出
12.解:(1)A、C碰后第一次由C到D的过程


(2)设A球在C点的碰前速度为



得
(3)从第一次过D点到第二次过D点的过程中,设第二次过D点速度为



得
高三理综(化学)参考答案及评分标准
第I卷每题6分,共36分
1
2
3
4
5
6
C
B
A
D
A
C
第Ⅱ卷(共64分)
7.(1)题每空1分,(2)~(6)题每空2分,共15分
(1)
(2)③⑥
(3)
(4)
(5)
(6)
8.(1)、(3)、(4)、(5)题每空2分,(2)、(6)题每题3分,共20分
(1) ,
,
(2)①②⑤
(3)3,6:1:1 或1:6:1或1::1:6
(4)6
(5) 2
2


(6)
9.(1)、(2)题每空2分,(3)题每空1分,(4)、(5)题各3分,共15分
(1)
(2)①可以控制反应、②吸收 气体,防止污染环境。
气体,防止污染环境。
(3) 。
。
(4)先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)②试管或用冰水使②试管降温(合理答案均给分)
(5)实验方案:用 和稀
和稀 反应,若所得溶液呈蓝色,则证明
反应,若所得溶液呈蓝色,则证明 和浓
和浓 反应呈绿色的原因是
反应呈绿色的原因是 溶解在溶液中造成的。(合理答案给分)
溶解在溶液中造成的。(合理答案给分)
10.每空1分,(1)~(3)每空2分,共14分
温度、
(1)1
(2)逆反应方向 吸热 
(3)等于 压强改变对该平衡无影响(或平衡常数只与温度有关)
高三理综(生物)参考答案及评分标准
1.B 2.D 3.C 4.A 5.C 6.B
7.(16分)
(1)光反应 暗反应
(2)① 光照强度
光照强度
(3)6 10.9
(4)
8.(12分)
(1)目的基因 重组DNA
(2)PCR(聚合酶链式反应) 限制酶、DNA连接酶
(3)农杆菌转化法(或显微注射技术) 受精卵
(4)从转基因羊的乳汁中提取蛋白质,用相应的抗体进行抗原―抗体杂交如果出现杂交带,表明奶牛中出现了抗原蛋白:如果不出现杂交带,表明奶牛中未出现抗原蛋白。
(5)让害虫吞食转基棉花的叶子,观察害虫的存活情况,以确定其是否具有抗虫性状
9.(16分)
(1)DDhh、ddHH
(2)从 中选取产氰个体自交,若后代不发生性状分离,即为能稳定遗传的个体
中选取产氰个体自交,若后代不发生性状分离,即为能稳定遗传的个体
(3)①多个基因决定一个性状
②基因通过控制酶的合成控制生物的代谢从而控制生物的性状
(4)氰糖苔(氰酸酶)
ddHH或ddHh(DDhh或Ddhh)
氰酸酶(含氰糖苔)
有氰生成则植株基因形为DDhh或Ddhh(ddHH或ddHh),无氰生成则基因型为ddhh(推论与基因型要对应)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com