
题目列表(包括答案和解析)
某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是 ( )
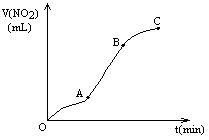
A.A段表示开始时,反应速率稍慢
B.B段表示反应速率较快,可能因为产物有催化作用
C.BC段表示反应速率最快,在该时间内收集到的气体最多
D.OC线表示随时间增大,反应速率逐渐增大
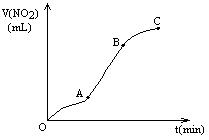
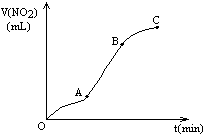
某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是
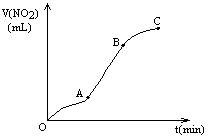
A. A段表示开始时,反应速率稍慢
B. B段表示反应速率较快,可能因为产物有催化作用
C. BC段表示反应速率最快,在该时间内收集到的气体最多
D. C段表示随时间增加,反应速率逐渐增大
I下列实验设计、操作或实验现象合理的是_________(填序号)
A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
 II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
II 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有过量乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液。试回答:
(1)A中浓硫酸的作用是
反应中加入的乙醇是过量的,其目的是________________________________。
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式 ;
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是_______________________ 。
(4)反应结束后D中的现象是 。
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰
1.C 2.D 3.CD 4.C 5.AC 6.AD 7.C 8.A 9.D 10.C 11.AB 12.A
13.B 14.D 15.B 16.B 17.BC 18.B
19.(1)NaOH;HClO4;Al(OH)3 (2)Ne;F;F2;Na (3)HF; (4)Na
阶段测试卷(A卷).files/image015.gif)
阶段测试卷(A卷).files/image016.gif)
阶段测试卷(A卷).files/image017.gif) 20. (1)D (2) 因原电池反应,铜将在银棒(正极)上析出而不是在铁棒上,所以应该是银棒下沉铁棒上升.
20. (1)D (2) 因原电池反应,铜将在银棒(正极)上析出而不是在铁棒上,所以应该是银棒下沉铁棒上升.
21.(1) ;离子键 (2)两种;
(3)复分解反应 (4)<
22.(1)△H =-92kJ/mol (2)△H=-30.6 kJ/mol
阶段测试卷(A卷).files/image018.gif)
阶段测试卷(A卷).files/image019.gif) 23. ⑴ N
③; ⑵ Sn
④; ⑶ Fe
①
23. ⑴ N
③; ⑵ Sn
④; ⑶ Fe
①
24.(1)NH4+;OH-; H2O ; NH3 (2)NH4+ + OH-== NH3 + H2O
25.O N S H
26. 呈现红色的部位发生了2H++2e = H2,而导致H+浓度下降,致使[OH-]>[H+],所以A是负极,B是正极
27. (1)v0=2.73×10-8 mol/(L•s)
(2)当I2消耗一半时,
c(CH3COCH3)=0.1mol/L―1/2×0.01mol/L=0.095mol/L,
c(H+)=0.1mol/L+1/2×0.01mol/L=0.015mol/L,此时的反应速率vt=2.73×10-5×0.095×0.015mol/(L•s)=3.89×10-8 mol/(L•s)显然 vt >
v0,所以反应速率比开始时快阶段测试卷(A卷).files/image014.jpg)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com