
题目列表(包括答案和解析)
| A | B | |
| C | D |




 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3 2NH3
2NH3

| 4(m-n) |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4n+m |
| 5 |
| 4m+3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| m-3n |
| 5 |
 .甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题:
.甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题: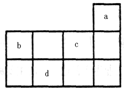 a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )
a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )| A、a原子的最外电子层上有8个电子 | B、c的最高价氧化物对应水化物为强酸 | C、d的原子半径比c的大 | D、b的非金属性比c的强 |
(1)写出下列元素符号:A____________;B____________;C____________;D____________。
(2)写出下列化合物的化学式:X____________;Y____________;Z____________。
(3)写出下列反应的化学方程式:
N和水反应:________________________________________________;
B的单质+Y![]() X+Z:____________________________________________。
X+Z:____________________________________________。
1.C 2.D 3.CD 4.C 5.AC 6.AD 7.C 8.A 9.D 10.C 11.AB 12.A
13.B 14.D 15.B 16.B 17.BC 18.B
19.(1)NaOH;HClO4;Al(OH)3 (2)Ne;F;F2;Na (3)HF; (4)Na
阶段测试卷(A卷).files/image015.gif)
阶段测试卷(A卷).files/image016.gif)
阶段测试卷(A卷).files/image017.gif) 20. (1)D (2) 因原电池反应,铜将在银棒(正极)上析出而不是在铁棒上,所以应该是银棒下沉铁棒上升.
20. (1)D (2) 因原电池反应,铜将在银棒(正极)上析出而不是在铁棒上,所以应该是银棒下沉铁棒上升.
21.(1) ;离子键 (2)两种;
(3)复分解反应 (4)<
22.(1)△H =-92kJ/mol (2)△H=-30.6 kJ/mol
阶段测试卷(A卷).files/image018.gif)
阶段测试卷(A卷).files/image019.gif) 23. ⑴ N
③; ⑵ Sn
④; ⑶ Fe
①
23. ⑴ N
③; ⑵ Sn
④; ⑶ Fe
①
24.(1)NH4+;OH-; H2O ; NH3 (2)NH4+ + OH-== NH3 + H2O
25.O N S H
26. 呈现红色的部位发生了2H++2e = H2,而导致H+浓度下降,致使[OH-]>[H+],所以A是负极,B是正极
27. (1)v0=2.73×10-8 mol/(L•s)
(2)当I2消耗一半时,
c(CH3COCH3)=0.1mol/L―1/2×0.01mol/L=0.095mol/L,
c(H+)=0.1mol/L+1/2×0.01mol/L=0.015mol/L,此时的反应速率vt=2.73×10-5×0.095×0.015mol/(L•s)=3.89×10-8 mol/(L•s)显然 vt >
v0,所以反应速率比开始时快阶段测试卷(A卷).files/image014.jpg)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com