
题目列表(包括答案和解析)
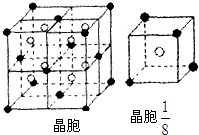
 A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.



| 1 | 8 |
根据以上信息,完成下列各题:
(1)A和D氢化物中,沸点较低的是_________(选填“A”或“D”);A和B的离子中,半径较小的是_________ (填离子符号)。
(2)元素C在元素周期表中的位置是_________。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图1-2-25所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是_________。

图1-2-25
根据以上信息,完成下列问题:
(1)A和D氢化物中,沸点较低的是__________(选填“A”或“D”);A和B的离子中,半径较小的是__________(填离子符号)。
(2)元素C在元素周期表中的位置是__________。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是__________。
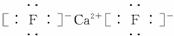
1―5ADCBD 6―10CBCCD 11―15CBCBD 16―20BDBDC
21.(6分)NH4I>NH4Br>NH4Cl>NH
接FCl Br I的顺序,半径增大,夺取质子的能力减弱。(3分)
22.(8分)(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O(2分)
(2)酸性 氧化性(各1分)
(3)0.6mol(2分)
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成(2分)
23.(8分)(1)D Na+
(2)第三周期 第IIIA族
(3)钙(每空2分)
24.(8分)(1)H-O-H 4NA (每空2分)
(2)①H2O>NH3>H2S (每空2分)
②SO2+2H2S==2H2O+3S↓(末写↓不扣分)(2分)
(2)
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)(1分)
负极反应:Cu=2Cu2++2e-(或Cu-2e-=Cu2+)(1分)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2―4.7;③过滤(除去Fe(OH)3)(各1分共3分)
(4)CuO+H2SO4=CuSO4+H2O(2分)
CuSO4+Fe=FeSO4+Cu(2分)
不锈钢表面有紫红色物质生成(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com