
题目列表(包括答案和解析)
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产了纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 ![]()
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特旬原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据 上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
|
第二同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O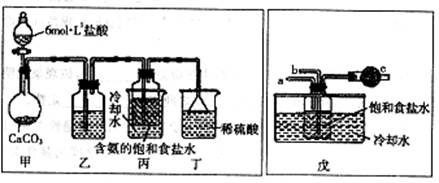
【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。

第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产了纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3=Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特旬原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据 上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
|
第二同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程如下:
NH3+CO2+H2O === NH4HCO3;NH4HCO3+NaCl === NaHCO3↓+NH4Cl;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。

第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
②装置c中的试剂为 (选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述): 。
1―5 BDDBA 6--8DAB
9.B【解析】蒸馏是利用物质的沸点不同进行分离的方法,属于物理变化,A错;蛋白质属于高分子,其溶液属于胶体具有丁达尔现象,葡萄糖分子属于小分子,其溶液无丁达尔现象,B正确;摩尔质量的单位是g?mol-1,C错;纯碱是碳酸钠,应水解呈碱性,属于盐,D错。【难易程度】易
10.A
【解析】
11.C【解析】澄清石灰水中Ca(OH)2完全电离,Ca(OH)2应写成离子,A错;混合后溶液恰好中性,H+离子与OH-恰好反应,NaHSO4与Ba(OH)2的物质的量之比为2:1,B错;Fe2+离子的还原性大于Br-,FeBr2中加入少量Cl2,首先氧化Fe2+,C正确;Al(OH)3不能与氨水反应,即不能Al3+与氨水反应不能生成AlO2-,D错。【难易程度】较易
12.D 【解析】FeS与CuS的化学式形式相同,可以直接通过溶度积常数比较二者的溶解度,Ksp越小,溶解度越小,A错;溶度积常数与物质的本性和温度有关,B错;物质的溶度积越小,越容易沉淀,B错;FeS的溶度积大于CuS的溶度积,其溶解平衡的S2-浓度远大于CuS的S2-离子浓度,故加入FeS可以沉淀废水中的Cu2+,D对。【难易程度】中
13.C 【解析】醋酸与氢氧化钠恰好反应,得到醋酸钠溶液,由于少量醋酸根离子的水解,使Na+浓度略小于CH3COO-浓度,OH-浓度大于H+浓度,A、B错;利用Na元素守恒,可以计算出醋酸钠的浓度为0.05 mol/L,根据元素守恒,也可以判断,醋酸与醋酸根离子浓度之和也是0.05 mol/L,C对;醋酸根离子水解生成的醋酸分子与OH-离子物质的量相同,但溶液中还有来源于水电离出的氢氧根离子,根据电荷守恒可以判断,D错误。【难易程度】中
14.B 【解析】溶液中加入Ba(NO3)2和盐酸,产生的白色沉淀可能为BaSO4、AgCl,其中SO42-也可能是SO32-、HSO3-被HNO3氧化生成的,故该过程不能确定溶液中是否有SO42-或Cl-,A、C错;溶液加入KSCN溶液变红色,说明有Fe3+,但由于原溶液中加入了Ba(NO3)2和 HCl,生成HNO3可将Fe2+离子氧化为Fe3+,故不能判断,原溶液中是否有Fe3+,D错;溶液加NaOH有气体生成,该气体只能是氨气,B正确。【难易程度】易
15.C 【解析】Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Al+4HNO3=Al(NO3)3+NO↑+2H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑;设硝酸的物质的量为x,金属的总物质的量为x/4,NaOH的物质的量为x/5,Al的物质的量为x/5,所以铁、铝的物质的量之比为(x/4?x/5):x/5=1:4,选C。【难易程度】中
16.B 17.BD 18.B 19.AC 20.C 21.AC 22.CD
 23.(1)(5分)BC
23.(1)(5分)BC
(2)①(3分) A1,V1,R1
②(5分)在右面方框中画出实验电路图。
③(4分)写出用测量的物理量表示Rx的表达式:
24.(15分)解:(1)设物块块由D点以初速 做平抛,落到P点时其竖直速度为
做平抛,落到P点时其竖直速度为
 …………1分
…………1分
 ……1分
……1分
得 …………1分
…………1分
平抛用时为t,水平位移为s, ……2分
……2分
在桌面上过B点后初速
BD间位移为 …………2分
…………2分
则BP水平间距为 …………1分
…………1分
(2)若物块能沿轨道到达M点,其速度为
 …………2分
…………2分
轨道对物块的压力为FN,则 …………1分
…………1分
解得
即物块不能到达M点…………2分
(3)设弹簧长为AC时的弹性势能为EP,物块与桌面间的动摩擦因数为 ,
,
释放 …………1分
…………1分
释放 …………1分
…………1分
且 …………1分
…………1分
 在桌面上运动过程中克服摩擦力做功为Wf,
在桌面上运动过程中克服摩擦力做功为Wf,
则 …………1分
…………1分
可得 …………1分
…………1分
25.(18分)
(1)(6分)粒子在两块平行金属板间的电场中,沿水平方向做匀速运动,竖直方向做
初速度为零的匀加速运动。粒子垂直AB边进入磁场,由几何知识得,粒子离开
电场时偏转角θ=30°。根据类平抛运动的规律有:
l=v0t ……………………1分
 ……………………1分
……………………1分
 ……………………2分
……………………2分
解得: ……………………2分
……………………2分
(2)(8分)由几何关系得:
 ……………………1分
……………………1分
粒子在磁场中做圆周运动的轨道半径为:
 ……………………2分
……………………2分
粒子进入磁场时的速率为:
 ……………………2分
……………………2分
根据向心力公式有:
 ……………………1分
……………………1分
解得: ……………………1分
……………………1分
结合左手定则知,磁场方向垂直纸面向里。 ……………………1分
(3)(4分)若两板间不加电压,粒子将沿水平方向以速率v0从AB边的中点进入磁场。当粒子刚好与BC边相切时,磁感应强度最小。设磁感应强度的最小值为B2,由几何关系知,对应粒子的最大轨道半径r2为:
 ……………………2分
……………………2分
根据向心力公式有:
 ……………………1分
……………………1分
解得: ……………………1分
……………………1分
26.(除注明外每空2分,共17分)
(1) B
(2)吞噬细胞、T细胞、B细胞、浆细胞(效应B细胞)(3分)
(3)体内快速产生大量抗体(写出其中一个关键词就可得分)(3分)
将未经免疫的大小、体质大致一致的小鼠注射等量的毒性极强的霍乱弧菌制剂(3分)
(4)不吃未煮熟的鱼类和贝壳类食物(或不生吃),或接种霍乱疫苗(答对1点即给分)
(5) 消费者 拟核、质粒、核糖体
27.(每空2分,共16分)
(1)基因突变 变异的不定向性 基因分离
(2) ①青毛┱白毛大致等于1┱1; ②b1>b3>b2>b4 ③b3>b1>b2>b4
(3)Bb4 青毛┱白毛┱褐毛=2┱1┱1
28.【解析】六种元素处于不同周期,原子序数依次增大,其中B、C同一周期,D、F同一周期,可以判断A为第一周期,B、C为第二周期,D、F为第三周期,A、D为同一主族,故A为H,D为Na,C、F为同一主族,且C原子的最外层电子数是次外层电子数的三倍,最外层电子数不能超过8个,故C的电子排布为K层2,L层6,故C为O,F为S;因此6种物质中有3中气体单质,其中已经判断出的氢、氧单质为气体,所以B、E必有一种为气体,D(Na)和F(S)之间无气体单质,故气体单质只能是处于A、C之间的B,该区间只有N形成气体,即B为N元素;E为位于D(钠)到F(S)之间的元素。
(1)A、B、C分别为H、N、O三元素;不难判断X为NH4NO3,其化学键类型为离子键、共价键;NH4NO3为强酸弱碱盐,水解显酸性。NH4++H2O NH3?H2O+H+。
NH3?H2O+H+。
(2)由题目信息可以判断,E为Si,与碱反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。
(3)由题目给出的信息,可以判断,该过程为H2与N2合成铵的反应,生成1 mol NH3放出的热量为:18.44kJ/( 2NH3(g) ΔH=-92.2 kJ?mol-1。
2NH3(g) ΔH=-92.2 kJ?mol-1。
(4)M极通入氢气,该极为电池的负极,其电极反应为:H2-2e-+2OH-=2H2O。
(5)SO2与O2生成SO3,反应式为2SO2+O2 2SO3,反应过程中剩余O2为:0.21 mol×
2SO3,反应过程中剩余O2为:0.21 mol×
29.【解析】海水中氯化钠的含量十分丰富,NaCl为重要的化工原料。(1)①NaCl为离子化合物,电解其熔融物,钠离子得电子生成熔融金属钠,Cl-离子失电子得到Cl2;②电解氯化钠溶液反应的化学方程式为:2NaCl+2H2O=2NaOH+H2↑+Cl2↑,n(NaOH)=n(H2)=2×112mL/22400mL?mol-1=0.01 mol,c(OH-)=c(NaOH)=0.01mol/ NaClO+H2↑。
NaClO+H2↑。
(2)将Fe2+离子转化为Fe3+离子需要加入氧化剂,可以选用NaClO或氯气,要使沉淀杂质沉淀完全,需要调整溶液的pH为9.8,过高Mg(OH)2会产生沉淀。
30.【解析】(1)①Zn与稀硫酸反应产生的氢气,中含有H2O蒸气,因此用检验H2的氧化产物H2O来验证氢气的还原性,必需使用干燥的氢气,氢气首先通过浓硫酸进行干燥,并通过无水硫酸铜检验干燥后的气体是否还含有水蒸气;干燥后的气体通过灼热的氧化铜,然后将反应后的气体通入盛有无水硫酸铜的装置,判断水的生成。②由于氢氧混合气加热容易爆炸,因此加热前需要对氢气验纯。
(2)①各装置的作用是,A装置,产生NH3和O2;C装置,干燥混合气体;B装置,NH3与O2催化氧化生成NO;C装置,吸收尾气,防止污染环境。②NH3催化氧化为放热反应,因此可以看到催化剂保持红热状态;在过量氧气存在是还有红棕色气体产生。
(3)①SO2与Na2O2若生成O2,可以参照CO2与Na2O2反应的方程式进行书写;②因为要检验SO2与Na2O2的反应,所以产生的SO2必需保证完全干燥,即SO2气体通过浓硫酸干燥,再通过盛有过氧化钠的装置,由于SO2污染大气,应添加尾气处理装置C,吸收SO2,但不能盛有E装置,因为E装置可能会有水蒸气与Na2O2反应。过氧化钠与SO2反应后,有淡黄色变为白色。
31.【解析】(1)合成氨为气体物质的量减少的放热反应,高压、低温有利于提高氨的平衡浓度,从勒沙特列原理可以选择bd。
(2)根据复分解反应完成的条件可知,NaHCO3的溶解度较小,是析出碳酸氢钠晶体的主要原因,选c。
(3)固液分离操作用过滤操作。由于CO2的溶解度较小,因此通入CO2前,应先从a管通入氨气(防止NH3倒吸),因为氨气、H2O、CO2反应生成NH4HCO3,可以大大提高CO2的吸收,b管通入CO2有利于CO2的充分吸收。
(4)可以将过量的CO2通入NaOH溶液或Na2CO3溶液中。
32.【解析】(1)对于主族元素来说,价电子排布实际上就是最外层电子排布,故N的价电子排布为2s22p3。
(2)p轨道夹角为90°,因此两N原子间成键只有一个p轨道“顶头”成键,另外两个轨道“平行”成键,故形成一个σ键,二个π键。
(3)①氮原子的最外层s轨道全充满,p轨道为半充满,比较稳定,而氧原子的p轨道失去一个电子成为较稳定的半充满状态,因此N的第一电离能大于O的第一电离能;②氮原子的半径小于P原子的半径,且N2分子中形成的是叁键,白磷中P-P键为单键,故氮分子中的氮氮键键长小于白磷中的磷磷键键长。
(4)根据氨分子的键角,可以判断,氨分子中氮的杂化方式为sp3杂化,由于N的电负性较大,氮原子有未成键的孤对电子,分子间能形成氢键,故氨是一种易液化的气体。
33.【解析】A分子式为C9H10O3氢原子的个数较少,可以初步判定A分子中含有苯环,A→B的反应条件是Cu催化与O2反应,该条件为醇的性质,可以判断A分子中含有醇羟基;B能发生银镜反应,证明A分子中含有-CH2OH结构;E能与溴水加成,说明A分子的一个侧链至少含有两个碳原子;A→H浓硫酸催化下形成环状化合物,证明A分子中还含有羧基;A有两个邻位取代基,故可以判断出A的结构简式为: ;依次可以判断数B为:
;依次可以判断数B为: ;C为:
;C为: ;E为:
;E为: 。根据以上判断的结果,不难做出正确的答案。
。根据以上判断的结果,不难做出正确的答案。
34.(8分)
(1)添加高浓度蔗糖(葡萄糖) 调低pH值 是否能在选择培养基上生长。
(2)隔绝空气
(3)缺乏相应分解酶系(或缺乏纤维素酶和半纤维素酶)
(4)结合在模板DNA上,提供DNA延伸起始位点; 催化DNA子链的合成。
35.(8分)
(1)限制性核内切酸 DNA连接酶 显微注射
(3)早期胚胎培养(受精卵培养) 胚胎移植 囊胚(桑椹胚)
(4)物质循环再生 协调与平衡
36.[选修3-3]
解;(1)
所吸进的空气分子的总数约为
(2)汽缸恶化隔板绝热,电热丝对气体  加热,气体
加热,气体 温度升高,压强增大,体积增大。(1分)
温度升高,压强增大,体积增大。(1分)
气体 对气体
对气体 做功,气体
做功,气体 的体积减小,压强增大,温度升高,内能增大。(3分)
的体积减小,压强增大,温度升高,内能增大。(3分)
37.[选修3-4]
解:(1)如图所示,根据图像,波的波长
波速为
波传的到Q点用的时间
(2)质点振动的周期:
P质点开始向下振动,波经P点传到Q点的时间为 周期
周期
则此时质点P的位移为
38.(8分)【物理――物理3-5】
(1)12.09 7.55(每空2分)
(2)①核反应方程式为 …………2分
…………2分
②设中子、氦核、新核的质量分虽为 ,
,
它们的速度分别为 ,根据核反应动量守恒有:
,根据核反应动量守恒有:
 负号说明新核运动方向与氦核相反。…………2分
负号说明新核运动方向与氦核相反。…………2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com