
题目列表(包括答案和解析)

(2)已知
B.Ksp(CaF2)随钙离子和氟离子浓度的增大而增大
C.该体系最终没有沉淀生成
D.该体系最终有沉淀生成
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(除CO2因逸出而未画)物质的量分数(纵轴)随溶液pH(横轴)变化的情况如下图。

请根据上图所示回答下列问题:
①在同一溶液中,H2CO3、![]() 、
、![]() (填“能”或“不能”) _________________大量共存。
(填“能”或“不能”) _________________大量共存。
②当pH=7时,用一个数学表达式表示溶液中各种离子的物质的量浓度之间的等量关系:_________________。
③已知在![]() (aq)水解反应的平衡常数:
(aq)水解反应的平衡常数:
Kh=![]() =2×10-4 mol·L-1
=2×10-4 mol·L-1
当溶液中c(![]() )∶c(
)∶c(![]() )=2∶1时,溶液的pH=_________________。
)=2∶1时,溶液的pH=_________________。
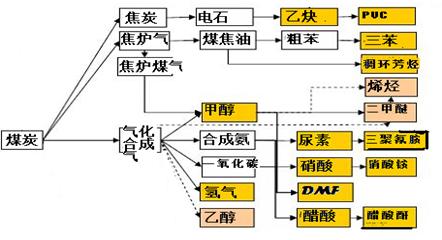
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)该产业链中合成氨的反应在较低温下能否自发进行? 。
(2)已知该产业链中某反应的平衡表达式为:
它所对应的化学反应为: 。
(3)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g) 2CO(g),K1
CO(g)+H2O(g H2(g)+CO2(g), K2
C(s)+H2O(g) CO(g)+H2(g) ,K3
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从图中看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是和
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
对反应N2O4(g)2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式 。
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)该产业链中合成氨的反应在较低温下能否自发进行? 。
(2)已知该产业链中某反应的平衡表达式为:
它所对应的化学反应为: 。
(3)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g  H2(g)+CO2(g), K2
H2(g)+CO2(g), K2
C(s)+H2O(g) CO(g)+H2(g) ,K3
CO(g)+H2(g) ,K3
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从图中看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为
。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为
。
对反应N2O4(g)
 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。

下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式 。
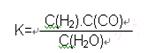
 2CO(g),K1
2CO(g),K1  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2 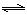 CO(g)+H2(g),K3
CO(g)+H2(g),K3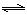 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
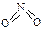 和
和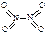 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。 2NO2(g),在温度为T1
2NO2(g),在温度为T1 、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。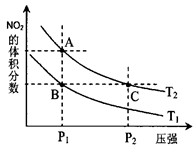
 点的反应速率:A>C
点的反应速率:A>C (8分)(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_________________

(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
评分说明:
1.本答案供阅卷评分时使用,考生若写出其它正确答案,可参照评分标准给分。
2.计算题只有最后答案而无演算过程的,不给分;只写出一般公式但未能与试题所给的具体条件联系的,不给分。
3.化学方程、离子方程式未配平的,都不给分。
生物部分
题号
1
2
3
4
5
答案
B
C
D
A
D
26.
Ⅰ.(14分,每空2分)
(1)a(2分) 光反应(2分) 色素的数量(2分)
(2)三碳化合物(或C3)(2分)
(3)①温度主要通过影响光合作用的酶的活性影响光合作用强度 (2分)
一定时间内,光合作用产生的氧气的量可反映光合作用的强度 (2分)
②一定时间内光合作用产生的O2气泡数 (2分)
.files/image095.jpg) Ⅱ.(12分)
Ⅱ.(12分)
(1)①藻类、大米草
②食草虫、线虫、海螺
③沼蟹、蜘蛛
(2)一龄幼虫
(3)减少
(4)抵抗力
27.(14分)(除(4)外,每空3分)
(1)显性
(2)套袋
(3)甜
(4)(5分)
基因型与表现形3分,符号1分,比例1分)
.files/image097.gif) |
32.(10分)
(1)a a (各2分,共4分)
(2)基因枪法(花粉管通道法)(3分)
(3)植物组织培养
化学部分
题号
6
7
8
9
10
11
12
答案
B
A
D
B
D
C
B
23.(15分)(1)4NH3+5O2.files/image098.gif) 4NO+6H2O(3分)
4NO+6H2O(3分)
(2)3.612×1024或6NA(2分)
(3)酸(1分) ①c(NH4+)
c(Cl―) (2分)
② c(NH3?H2O)(2分)
(4)① 2Al+2OH―+2H2O=2AlO2―+3H2↑(3分)
② O2+H2O+4e―= 4OH―(2分)
24.(15 分)
(1)NO2 (g)+CO(g)=CO2(g)+NO(g) △H= -234kJ?mol―1 (3分);
―760.3kJ?mol―1 (2分)
(2)① .files/image099.gif) (2分),放(2分) ② 49.6%(2分),不变(1分)
(2分),放(2分) ② 49.6%(2分),不变(1分)
③ c (1分) 1.51×10-3mol?L-1?s-1 (2分)
25.(15分)
(1)①H2O2或H2O(化学式或名称均给分)(1分);c(每空1分)
② 将广口瓶中盛满水,从d管通入NO(2分)
(2)(5分)
猜想物质的
化学方程式
检验需要的试剂
操作、现象和结论
①
Na2SO4
稀盐酸和BaCl2溶液
取少量该溶液于试管中,若无明显现象,再滴入BaCl2溶液,如果生成白色沉淀,则原溶液是Na2SO4溶液。
②
Na2CO3
稀盐酸、品红试纸和澄清石灰水
取少量该溶液于试管中,滴入稀盐酸,若产生的无色气体不能使湿润的品红试纸变红,但能使澄清石灰水变浑浊。原溶液是Na2CO3溶液
③
Na2SO3
稀盐酸、品红试纸
取少量该溶液于试管中,滴入稀盐酸,若产生无色气体能使湿润的品红试纸变红,原溶液是Na2CO3溶液
④
Na2SiO3
稀盐酸
取少量该溶液于试管中,滴入稀盐酸,若产生白色沉淀,则原溶液是Na2SiO3溶液
⑤
Na2S2O3
稀盐酸
取少量该溶液于试管中,滴入稀盐酸,若产生无色气体和淡黄色沉淀,则原溶液是Na2S2O3溶液
(3)①取一片pH试纸置于洁净的玻璃片上,用玻璃棒蘸取溶液,点滴在pH试纸中央,
待变色后,与标准比色卡对照;(2分)
取最后一次洗涤液,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净 (2分)
② 将溶液加热浓缩,冷却结晶; 蒸发皿,酒精灯,玻璃棒。(2分)
30.(13分,未标注每空2分)
(1)1 s22s22p63s23p63d54s2或[Ar]3d54s2
(2)72.8 kJ?mol-1
(3)<
(4)Si、1
(5)甲醇分子间存在氢键,而甲醛没有,1(1分)
物理部分参考答案
题号
13
14
15
16
17
18
29(1)
29(2)
答案
D
C
B
AC
BC
D
A
B
19.(21分)
(1)(4分)① B (3分) ②木块重量 摩擦力 (3分)
(2)(15分)① B (3分)
② 作图(2分) E=1.48±0.02 (3分) r=0.83±0.02 (3分)
③ 偏小 (2分) 偏小 (2分)
20.(15分)
解:(1)当汽车的速度与自行车的速度相等时两车的距离最远,则:
.files/image101.gif) (3分)
(3分)
代入数据得: .files/image103.gif) (2分)
(2分)
最远距离:.files/image105.gif) (3分)
(3分)
(2)汽车追上自行车时,二车位移相等,有:
.files/image107.gif) (3分)
(3分)
.files/image109.gif) (2分)
(2分)
汽车的速度:.files/image111.gif) (2分)
(2分)
21.(16分)
解:(1)开始运动时,棒中的感应电动势:
.files/image113.gif) (3分)
(3分)
棒中的瞬时电流: .files/image115.gif) (3分)
(3分)
棒两端的瞬时电压: .files/image117.gif) (3分)
(3分)
(2)由能量转化与守恒定律知,全电路在此过程中产生的焦耳热:
.files/image119.gif) (4分)
(4分)
∴棒中产生的焦耳热为:.files/image121.gif) (3分)
(3分)
22.(20分)解:
(1).files/image123.gif) 在竖直方向做自由落体运动
在竖直方向做自由落体运动
有H=.files/image125.gif)
.files/image127.gif) (3分)
(3分)
代入数据解得.files/image129.gif) =
=.files/image131.gif) s (2分)
s (2分)
(2)设.files/image123.gif) 的质量为
的质量为.files/image133.gif) ,着地速率为
,着地速率为.files/image135.gif) ,根据机械能守恒定律
,根据机械能守恒定律
有.files/image125.gif)
.files/image133.gif)
.files/image137.gif) =
= .files/image125.gif)
.files/image133.gif)
.files/image139.gif) +
+ .files/image133.gif)
.files/image141.gif) ① (3分)
① (3分)
代人数据解得.files/image135.gif) =
=
.files/image143.jpg) (3)
(3).files/image123.gif) 着地时恰与
着地时恰与.files/image145.gif) 相撞,说明A2在水平地面一定以速度
相撞,说明A2在水平地面一定以速度.files/image041.gif) 向
向
右做匀速运动,因.files/image145.gif) 受到如图所示的五个力作用,故由平衡条件有:
受到如图所示的五个力作用,故由平衡条件有:
.files/image149.gif) ②
(3分)
②
(3分)
.files/image151.gif) ③ (3分)
③ (3分)
由③式代入数据得N=0.9 N (2分)
代人②式解得.files/image153.gif) =0.3
(2分)
=0.3
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com