
题目列表(包括答案和解析)
| 热值 | 目前市价 | |
| 液化气 | 109MJ/m3 | 2.6元/Kg |
| 管道煤气 | 15.6MJ/m3 | 0.90元/m3 |
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
| 加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
 (1)在初中化学中,我们学习了溶液的有关知识.
(1)在初中化学中,我们学习了溶液的有关知识.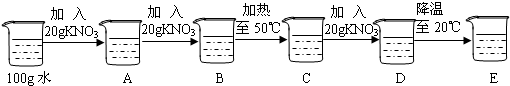
| 物质 | 与众不同的物质 | 理由 |
| KCl K2SO4 K2CO3 BaCO3 |
KCl | KCl中不含氧元素,其他物质中都含有氧元素 |
BaCO3 BaCO3 . |
BaCO3为难溶性盐,其它盐易溶(或“BaCO3为钡盐,其它为钾盐.”) BaCO3为难溶性盐,其它盐易溶(或“BaCO3为钡盐,其它为钾盐.”) . |

一、本大题包括10小题,每小题2分,共20分。
1.B 2.A 3.A 4.B 5.D 6.C 7.D 8.D 9.C 10.D
二、本大题包括5小题,共34分。
11.(7分)(每空1分,化学方程式2分)
(1)维生素 (2)A C (3)煤;风能(合理答案均给分);2H20 化学试题.files/image037.gif) 2H2↑+ 02↑;
2H2↑+ 02↑;
A 、B 、D(填2个正确给1分,只填1个不给分)
12.(7分)(计算2分,其余每空1分)
(1)降低温度、加入硝酸钾、蒸发水(溶剂)(答出任一点得分)
(2)B;17.3%;试管①中固体逐渐减少以至消失,试管②中有固体析出
(3)C
13.(8分)(1)①③⑤⑥⑦⑧(2分);(2)
2KMnO4化学试题.files/image039.gif) K2MnO4+MnO2+O2 ↑(2分)
K2MnO4+MnO2+O2 ↑(2分)
(3)石灰石、稀盐酸(1分)燃着的蜡烛由下至上依次熄灭(1分);二氧化碳的密度大于空气的密度,且不支持燃烧。(2分)
14.(5分)(1)碳酸钾(或K2CO3)(1分)(2)2 (1分)⑶硝酸钙、氯化钾、硝酸钾 (或Ca(NO3)2、KCl、KNO3)(3分)
15.(7分)【作出猜想】乙 (1分)
氧化铜、活性炭在常温下都不能与氧气反应 (2分)
4Fe + 3O2 = 2Fe2O3 (2分)
【设计实验】(2分)
1. 取样,将磁铁靠近样品,黑色粉末被吸起,黑色粉末是铁粉;
2. 取样,滴加稀硫酸,粉末表面有气泡产生,黑色粉末为铁粉;
3. 取样,滴中硫酸铜溶液,粉末表面出现红色固体,黑色粉末为铁粉;
4. 取样,在潮湿的空气中放置几天,样品中出现红色固体,黑色粉末为铁粉。
(合理答案均可)
三.本大题共6分。
16.每天服用氢氧化镁的质量是:
设理论上可中和HCl的质量是x。
Mg(OH)2+2HCl=MgCl2+2H2O 1分
58 73
化学试题.files/image041.gif)
化学试题.files/image043.gif) 1分
1分
化学试题.files/image041.gif) =
=
答:患者按此处方服用该药一天,设理论上可中和HCl的质量是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com