
题目列表(包括答案和解析)





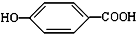 ),其反应类型
),其反应类型

下列叙述中完全正确的是
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2NA
⑦室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
⑧标准状况下,测得一定量的铜与浓硝酸反应后生成22.4 L的气体,则被还原的硝酸的分子数一定等于NA
⑼精炼铜过程中阳极减轻6.4g时,电路中转移电子数是0.2NA
⑽常温常压下,2.24L四氯化碳中所含氯原子数大于0.4NA
(11)在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
副题:下列叙述中完全正确的是
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2NA
⑦室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
⑧标准状况下,测得一定量的铜与浓硝酸反应后生成22.4 L的气体 ,则被还原的硝酸的分子数一定等于NA
⑼精炼铜过程中阳极减轻6.4g时,电路中转移电子数是0.2NA
⑽常温常压下,2.24L四氯化碳中所含氯原子数大于0.4NA
(11)在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
一、选择题:1-5:BCADD 6-10:BCADB 11-15:DCDCD 16-21:ACBDCC
 二、非选择题:
二、非选择题:
22:(每空2分)⑴①0、6 ②偏小 偏小
⑵①见后图。
②伏安法估测的值; 1000
③电流表; 15Ω
23:用手固定木板时,对小球有 F1=mgSinθ (4分)
木板沿斜面下滑时,对小球有 mgSinθ―F2=ma (4分)
木板与小球一起下滑有共同的加速度,对整体有
(M+m)gSinθ―Ff =(M+m)a (4分)
Ff = μ(M+m)g Cosθ (2分)
得:μ=F2tanθ / F1 (2分)
24;⑴设打在荧光屏上的带电粒子具有的动能为Ek
根据动能定理有:qEd=Ek - mV02/2 (4分)
Ek=qEd + mV02/2 (2分)
⑵带电粒子初速度与电场方向垂直时,做类似平抛运动,沿场强方向a=qE/m(2分)
d =at2/2 (2分)
到达B板的时间t1=
 (1分)
(1分)
粒子到达B板时具有沿场强方向的速度Vby=at=  (1分)
(1分)
从B板到达M板所用时间为 t2= =
= (2分)
(2分)
粒子运动总时间t=t1+t2=(2d+L) (2分)
(2分)
荧光屏上闪光范围是个圆,其半径R=V0t=V0(2d+L) (2分)
(2分)
25:⑴A第一次与B碰撞前,B是保持静止状态,设A碰撞前的速度为VA,由动能定理得:
―μmgL=mVA2/2 ― mV02/2 (4分)
A、B组成的系统在第一次碰撞过程中动量守恒,设此时B的速率为VB,选向右为正方向,则:mVA=m(―V1)+MVB (4分)
得:VB=(V1+ )/ 5
(2分)
)/ 5
(2分)
⑵最后一次碰撞后的过程中,设B停止运动时A的速度为V,对A由动能定理得:
μmgs=0―mV2/2 (4分) V= (2分)
(2分)
⑶研究A、B组成的系统,它在水平方向所受的外力就是地面对盒B的滑动摩擦力,设盒B运动的总时间为t,选向右为正方向,由系统的动量定理得(或分别对A、B用动量定理联列得出) ―μ(M+m)gt=mV ― mVA (4分)
t = (2分)
(2分)
26:⑴第3周期,第VIA族(2分)
⑵共价键和离子键(2分) NH3(2分)
NH3+H3O+=NH4++H2O或NH3+H3O=NH4++OH - (2分)
⑶ 0、3molNa2O2,0、1molNa2CO3 (4分)
⑷3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+(4分,合理的都给分)
27:⑴  (1分)
使湿润的红色石蕊试纸变蓝(1分,其它合理答案均可)
(1分)
使湿润的红色石蕊试纸变蓝(1分,其它合理答案均可)
⑵4OH--― 4e--=O2↑+2H2O(3分)
⑶4Fe(OH)2+O2+2H2O=4Fe(OH)3(3分) Fe2O3+2Al=2Fe+Al2O3 (3分)
⑷Fe+4H++NO3--=Fe3++NO↑+2H2O(3分)
⑸(NH4)2Fe(SO4)2 (2分)
⑹ H2(g)+1/2 O2(g)==H2O(l);△H=-2b/a KJ/mol (3分)
28:⑴在B中加入蒸馏水至淹没玻璃导管a的下端,关闭活塞b,微热A装置中的烧瓶,若导管a中的液面上升一定的高度,则气密性良好。(2分)
⑵ 4H++2Cl-+MnO2=△=Mn2++Cl2↑+2H2O(2分) ①③④(2分)
⑶①洗去Cl2中的HCl气体;②安全瓶(2分)
⑷防止AlCl3凝结堵塞导管。(2分)
⑸将固体AlCl3溶于较浓的盐酸,然后加入蒸馏水稀释至所需浓度。(2分)
⑹  (2分) ⑦(1分)
(2分) ⑦(1分)
29:⑴碘酸钾受热容易分解(2分)
⑵IO3-+5I―+6H++==3I2+3H2O(2分)
取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+ (2分)
⑶39、7mg/Kg;在20∽40mg/Kg的范围内。(4分)
30:Ⅰ⑴下丘脑体温调节中枢
⑵甲状腺激素 肾上腺素 ④
⑶缺氧
Ⅱ⑴A
⑵同位素标记法 C3
⑶a:气温降低,促进有机物向根部运输
b:土温降低,抑制有机物向根部运输,促进有机物向上部叶片运输
31:⑴脱落酸 拮抗
⑵细胞伸长 细胞分裂
⑶无定形的薄壁 稳定
⑷a:缺少蒸馏水处理的空白对照 步骤a应加入等量的
每个试管加入2粒种子太少 步骤c蒸馏水错误,应为相应浓度的生长素溶液
b:用不同的植物种子重复上述实验
c:
培养皿
1
2
3
4
5
6(蒸馏水)
种子萌发率
幼苗生长平均长度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com