
题目列表(包括答案和解析)
(5分)为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
题号 | 实验要求 | 答案 |
(1) | 从碘水中提取碘单质 | |
(2) | 提纯混有少混NaCl的KNO3 | |
(3) | 鉴别NaCl和KCl | |
(4) | 测定某工业废水的酸碱度 | |
(5) | 检验自来水中残余氯分子 |

A.(物质结构与性质)A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3 倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为_____________,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于_____________,A与C所形成的化合物的熔、沸点明显高于A与C的同主族元素所形成的化合物的熔、沸点,其原因是_____________________________________________________________________。
(2)当n=2时,B原子的结构示意图为_________,B与C形成的晶体属于________晶体。
当n=3时,B与C形成的晶体中,B原子的杂化方式为________________________,该晶体中最小的环共有________个微粒构成,微粒间的作用力是____________________________。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是_____________,A、B、C、D四种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
B.(实验化学 )某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。

(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100 mL气体A进行实验,实验记录如下:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
B中的现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为_____________。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?_____________(填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?_____________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
a | 在烧瓶中加热适量浓硝酸 4HNO3 | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
b | 加热AgNO3固体 2AgNO3 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
c | 加热Cu(NO3)2固体 2Cu(NO3)2 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a.__________,原因是__________________________________________________。
b.__________,原因是__________________________________________________。
c.__________,原因是__________________________________________________。
(A)【物质结构与性质】
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

(1)T3+的核外电子排布式是____________。
(2)Q、R、M的第一电离能由大到小的顺序是___________________(用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是______________________(填序号)。
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线形分子,不存在配位键。写出其结构式:_________________。
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是____________(填G或R的元素符号)。

(B)【实验化学】
某资料显示,能使双氧水分解的催化剂有很多种,生物催化剂(如猪肝)、离子型催化剂(如FeCl3)和固体催化剂(如MnO2)等都是较好的催化剂。某实验小组通过测定双氧水分解产生的O2的压强,探究分解过氧化氢的最佳催化剂以及探究最佳催化剂合适的催化条件。
(一)探究一:
实验步骤
(1)往锥形瓶中加入50 mL 1.5%的双氧水
(2)分别往锥形瓶中加
(3)采集和记录数据。
(4)整理数据得出下表
不同催化剂“压强对时间斜率”的比较
催化剂 | 猪肝 | 马铃薯 | 氯化铜 | 氯化铁 | 氧化铜 | 二氧化锰 |
压强对时间的斜率 | 0.191 87 | 0.002 42 | 0.007 93 | 0.030 5 | 0.015 47 | 1.833 6 |
①该“探究一”实验的名称是_____________________________________________________。
②该实验所得出的结论是_______________________________________________________。
(二)探究二:二氧化锰催化的最佳催化条件
该实验小组的同学在进行探究二的实验时,得到了一系列的图表和数据。参看下图和表格分别回答相关问题。

3%的双氧水与不同用量二氧化锰的压力—时间图
表:不同浓度的双氧水在不同用量的二氧化锰作用下收集相同状况下同体积O2所需时间
MnO2 时间 H2O2 | |||
1.5% | 223 s | 67 s | 56 s |
3.0% | 308 s | 109 s | 98 s |
4.5% | 395 s | 149 s | 116 s |
分析图、表中数据我们可以得出:
③同浓度的双氧水的分解速率随着二氧化锰用量的增加而_________________,因而反应时间_______________。
④如果从实验结果和节省药品的角度综合分析,你认为当我们选用3.0%的双氧水,加入___________ g的二氧化锰能使实验效果最佳。你判断的理由是______________________。
⑤该小组的某同学通过分析数据得出了当催化剂用量相同时双氧水的浓度越小反应速率越快的结论,你认为是否正确____________,你的理由是________________________________。
A.《物质结构与性质》
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;基态Ni原子的电子排布式为__________。
(2)配合物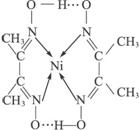 分子内的作用力有____________(填编号)。
分子内的作用力有____________(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如下图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为____________。

B.《实验化学》
乙醛与银氨溶液的反应常因条件控制不当,会出现黑色浊液、长时间没有银析出、析出的银镜不均匀或发暗等现象,影响了银镜反应的效果。
某研究小组为探究乙醛发生银镜反应的最佳实验条件,进行了有关实验,相关数据如下表:
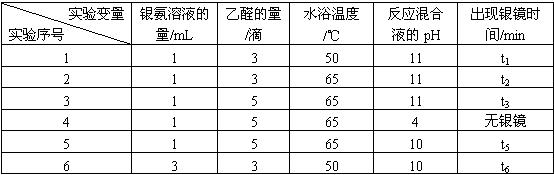 请回答下列问题:
请回答下列问题:
(1)写出乙醛与银氨溶液发生银镜反应的化学方程式:_______________________________。
(2)若只进行实验1和实验2,其探究的目的是_____________。
(3)实验__________(填序号)组合,可探究混合液pH对银镜反应的影响。
(4)实验4无银镜出现的原因是_____________________________________________。
(5)试管内壁的银镜用硝酸洗涤,可以回收硝酸银溶液。你认为选用____________(填“浓硝酸”或“稀硝酸”)较好,理由是___________________________________________________。
(安徽省08-09年10月涡阳二中高三测试化学试题)下列各物质形成的分散系中,不能发生丁达尔现象的是
A.淀粉水溶液 B.蛋白质水溶液
C.硬脂酸钠和甘油的混合溶液 D.蔗糖水溶液
第Ⅰ卷(选择题,共45分)
1. D 2.C 3.C 4.D 5.C 6.D 7.C 8.B 9.B 10.C
11.D 12.A 13.D 14.D 15.D
第Ⅱ卷 (非选择题,共55分)
16.(10分)(1)KIO3(2分);淀粉溶液(2分)。
(2)4KI+02+2H20 → 2I2 + 4KOH(只要能表示出KI、02和I2即可得分,不配平不扣分)
(2分)
(3)C→B→D→A→G→H→E→F(2分)
使漏斗下端管壁紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出。(2分)
17.(13分)(1)空气污染、酸雨(2分);2S02+ 02 =2S03
SO3+H20=H2SO4(或SO2+H2O=H2SO3 2H2SO3+02=2H2SO4)(4分)
(2)CaCO3+SO2=CaSO3+CO2↑ 2CaSO3+O2=2CaSO4(4分)
(3)CaO [或石灰石均可得分](3分)
18.(16分)(1)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气。(4分)
(2)偏小(1分),将广口瓶中的水改为饱和CO2水溶液(或在水面上覆盖一层植物油等)
(2分)。
(3)Ⅰ没有吸收圆底烧瓶水蒸汽的装置;Ⅱ球形干燥管与空气相通;Ⅲ反应结束后,装置内残留的C02不能完全排出。(其他合理答案可酌情给分)(3分)
(4)过滤(或过滤洗涤)(1分);干燥(或烘干)(1分)。
静置,在上层清液中继续滴加CaCl2溶液,若无沉淀证明沉淀已完全。(2分)
(5)  (2分)
(2分)
19.(16分)
(2)放热(1分);放出氧气(1分)。
(3)I可能CO2过量,瓶中02少,CO2多(1分)。 3(1分)。
Ⅱ发烫(1分)。 2(1分)。
Ⅲ塞上带导管的橡皮塞(2分),澄清石灰水(1分)。澄清石灰水变浑浊(1分)。 1(1分)。
(4) Na2O2部分变质或滴入的水太多(2分);生成的NaOH使酚酞变红,但Na2O2或
H202具有强氧化性,将酚酞氧化而漂白。(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com