
题目列表(包括答案和解析)
根据下列装置图回答问题。
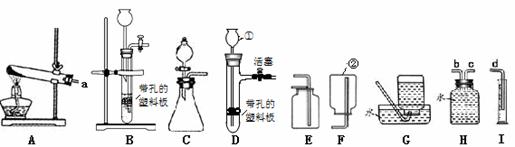
Ⅰ.写出仪器①的名称是 ⑻ ,仪器②的名称 ⑼ 。
Ⅱ.实验室用一定质量的氯 酸钾制取氧气,通过排水量测定所收集到的氧气体积。
酸钾制取氧气,通过排水量测定所收集到的氧气体积。
①写出该反应的化学方程式 ⑽ 。
②若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请画出⑾ 。
③根据氯酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是 ⑿ 。
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究。
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关。
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克HCl的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
根据以上信息回答下列问题:
写出上述实验中反应的化学方程式 ⒀ 。
实验①与②的目的是为了探究 ⒁ 。
实验 ⒂ (填实验编号)的目的是为了探究大理石颗粒粗、细对反应快慢的影响。
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快。
拓展与反思:还有哪些因素可能影响该反应的速率快慢呢?请写出你的一个猜想: ⒃ 。
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有启普发生器原理 的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体, 该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。

| ||
| ||
| ||
| ||
(10分)请根据下列实验装置图回答有关问题: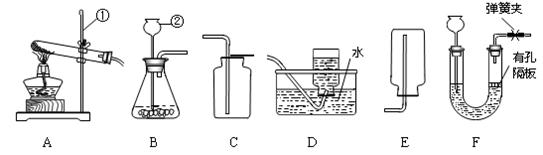
(1)请写出标号仪器的名称:① ,② 。
(2)实验室选用B、D装置制取O2,反应的化学方程式是 ;
(3)选择发生装置B和收集装置 (选填序号)可用于实验室制取较为干燥的CO2,对应的化学方程式是 ;若将发生装置由B改为F,其优点是 。若将收集装置改用下图G所示医用塑料袋,则气体导入端为 (填“a”或“b”)。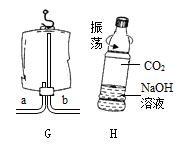
(4)用上图H所示的矿泉水瓶进行对比实验,可以证明CO2与NaOH溶液确实发生了反应,应做的对比试验是 。
请根据下列装置,回答问题:
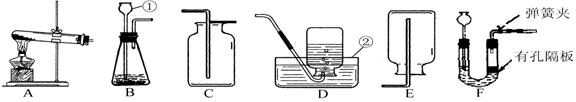
 |
(1)写出标号①和②的仪器名称 。
(2)装置B中仪器①的下端管口要浸在液面下,是为了 。
(3)实验室加热暗紫色固体制取O2的反应符号表达式为 ,若用排水法收集气体,当观察到_____ ___时才开始收集;停止实验时,应该_____ _____ _,否则_______________ ____________。
(4)若用装置C、D或K收集O2,要使收集O2干燥且纯净,则应选 装置。若用排水法收集到的O2不纯,可能的原因是?(两条)_____________ ____________、_________________ ___________。
若用向上排空气法收集氧气,如何验满?_________ ____________ _________。
实验过程中发现水槽中的水变成了浅紫红色,可能的操作原因:_____ ___________ 。
(5)用过氧化氢溶液与二氧化锰制取O2,装置G虽然操作简便,但要得到平稳的气流,从H、I、J中选取 取代G中的单孔塞,以达到目的。若选用H与锥形瓶组装的发生装置,当反应停止时,集气瓶中还差少量O2,为集满O2,在不拆卸装置的前提下,可以 、
。实验结束后,该同学发现收集到的气体比预计的少很多,百思不得其解。你认为可能的原因是:___________ ___ _________。
(6)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是 (填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(7)实验室利用F装置制备氢气,事先将锌粒放于有孔隔板之上,然后从另一端加入稀盐酸,装置F相对于装置B制备氢气,具有的优点是 。若用L装置收集氢气,则气体从 端通入(填“a”或“b”,下同);若要将L装置中的氢气用水排出,则水从 端通入。
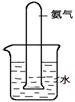 (8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物
(8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物
的方法制取氨气(NH3),同时还生成氯化钙(CaCl2)和水,则该反应的符号表达式为
;另外,氨气有刺激性气味且极易溶于水,则在
实验室里氨气的制取装置是_________。小军设计了如图所示的一个实验:充满氨气的
一支试管倒置于一个装有足量水的烧杯中。一段时间后,将会看到: 。
(9)某化学小组在学习了制取O2后,他们发现在实验室里用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃。同学们经过认真观察,猜想其可能原因是 。
为了验证此猜想是否正确,兴趣小组的同学经过热烈讨论,制定了实验方案并进行了实验。
第一组同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,
 一段时间后,用带火星的木条检验,木条复燃;
一段时间后,用带火星的木条检验,木条复燃;
第二组同学在5%的H2O2溶液中加入2滴新制氢氧化钠溶液,加热
一段时间后,用带火星木条检验,木条复燃;
第三组同学从实验装置上进行了改进,效果很好(见图)。
在实验基础上,同学们经过交流讨论,得出了一些结论:
①由第一组实验可得出影响H2O2分解产生O2多少及快慢的因素之一是 ;
②由第二组实验可分析得出氢氧化钠所起的作用可能是 ;
③第三组实验验证了实验前同学们猜想的正确性。其中浓硫酸的作用是 ;
④小李同学认真观察了第三组同学的实验装置,提出了一种简单的改进装置,经现场实验,效果很好,请你说出他改进的地方: 。


一.单项选择题(每小题3分,共36分)
1. D 2. C 3.D 4.A 5.B 6.C 7.C 8.C 9.C 10.B 11.D 12.D
二.不定项选择题(每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对的得4分,漏选得2分,错选不选得0分。)
13.BC 14. B 15.CD
三.填空简答题(共35分)
16.(6分,每空1分) (1) ①C ②A ③D ④B (2) ①CO2 ②CH4
17.(每空1分共3分)足够的热量; 化学; 有机物;
18.(每空1分共7分)(1)碱 C (2)过滤(专有名词,出现错别字不得分)
(3)活性炭(写“活性碳”、“木炭”不得分)(4)稀盐酸(或“盐酸”、“氯化氢溶液”、“氯化钙溶液”、“氯化钡溶液”等,写“硫酸”、“HCl” 、“HCl溶液”不得分) (5)工业废水处理达标后才能排放(或“基地内生活污水不要任意排放”等科学合理即可、写“农药、化肥不要滥用”不得分)
19.(每空1分共6分)(1)19.00(写“
20.(8分,每空2分) 丙 乙 相等 降温结晶
21.(方程式2分,共5分)(1)氢气 乙>甲>丙(或“乙、甲、丙”,写
“丙<甲<乙”不得分)(2分) (2)Ca(OH)2 +H2SO4= CaSO4 + 2H2O (未配平扣一分)
四.实验探究题(共24分)
22.(共8分)(1)B:集气瓶,H:酒精灯 (2)2H2O2 2H2O+O2↑;(2分) G;
2H2O+O2↑;(2分) G;
(3)水或细沙
(4)AC(填对一个给1分,有错不给分,共2分)
23.(每空1分,共6分) (1)盐 (2)澄清石灰水 澄清石灰水变浑浊(写“有白色沉淀生成”、“有沉淀生成”均可得分) (3)快 一片研碎的药片
【拓展探究】对身体无害(或“安全无毒”等均可得分)
24.(每空2分共10分)(1)气密性(2)B;(3)2Al+6HCl=2AlCl3+3H2↑;不能;因为该反应会放出气体,无论该反应是不是放出热量,导管口都会有气泡冒出。
五.计算题(共13分)
25.(每空2分共6分)
(1)27(2)72∶5 (3)72
26.(共7分)(1)(每空2分) = Na2SO4(2)(3分) 12%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com