
题目列表(包括答案和解析)
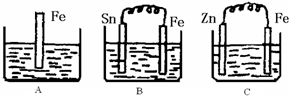
 2Z
2Z 2Z
2Z




③2F2+2H2O![]() 4HF+O2 ④2Na+2H2O
4HF+O2 ④2Na+2H2O![]() 2NaOH+H2↑⑤2Na2O2+2H2O
2NaOH+H2↑⑤2Na2O2+2H2O![]() 4NaOH+O2↑ ⑥SiO2+2NaOH
4NaOH+O2↑ ⑥SiO2+2NaOH![]() Na2SiO3+H2O ⑦Fe3O4+4H2
Na2SiO3+H2O ⑦Fe3O4+4H2![]() 3Fe+4H2O
3Fe+4H2O
(1)上述反应中,不属于氧化还原反应的有__________(填序号,下同);H2O被氧化的是__________;H2O被还原的是_____________________;属于氧化还原反应,但其中的H2O既不被氧化,也不被还原的是_____________________。
(2)写出化学方程式②的离子方程式:__________________________________________。
③2F2+2H2O![]() 4HF+O2 ④2Na+2H2O
4HF+O2 ④2Na+2H2O![]() 2NaOH+H2↑⑤2Na2O2+2H2O
2NaOH+H2↑⑤2Na2O2+2H2O![]() 4NaOH+O2↑ ⑥SiO2+2NaOH
4NaOH+O2↑ ⑥SiO2+2NaOH![]() Na2SiO3+H2O ⑦Fe3O4+4H2
Na2SiO3+H2O ⑦Fe3O4+4H2![]() 3Fe+4H2O
3Fe+4H2O
(1)上述反应中,不属于氧化还原反应的有__________(填序号,下同);H2O被氧化的是__________;H2O被还原的是_____________________;属于氧化还原反应,但其中的H2O既不被氧化,也不被还原的是_____________________。
(2)写出化学方程式②的离子方程式:__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com