
题目列表(包括答案和解析)
一瓶Na2SO3已部分被氧化,必须通过实验确定其纯度,正确的操作顺序是……( )
①称取样品;②用蒸馏水溶解样品;③过滤;④在烘箱中烘干沉淀;⑤向溶液中加过量的用盐酸酸化的BaCl2溶液;⑥用蒸馏水洗涤沉淀并再用AgNO3溶液检验,不出现沉淀为止;⑦准确称量干燥沉淀的质量;⑧在干燥器中冷却;⑨计算。
A、①②③⑥⑤④⑧⑦⑨ B、①②⑤③⑥④⑧⑦⑨
C、①②③④⑤⑧⑥⑦⑨ D、①②③⑤⑥④⑧⑦⑨
 (08上海闽行区模拟) (B)(12分)(1)某同学用托盘天平称量8.0gNaOH固体,则需先称量一个烧杯的质量,用“↓”表示在托盘天平上放上砝码,用“↑”表示在托盘天平上取下砝码,称量过程如右图所示,此时天平平衡,则烧杯的质量为_________g;在右盘再放________g砝码,将游码移至______g位置,然后向烧杯中加入NaOH固体,直至天平平衡。
(08上海闽行区模拟) (B)(12分)(1)某同学用托盘天平称量8.0gNaOH固体,则需先称量一个烧杯的质量,用“↓”表示在托盘天平上放上砝码,用“↑”表示在托盘天平上取下砝码,称量过程如右图所示,此时天平平衡,则烧杯的质量为_________g;在右盘再放________g砝码,将游码移至______g位置,然后向烧杯中加入NaOH固体,直至天平平衡。
(2)常见的粗盐主要含有NaCl和少量的MgCl2、CaCl2,由于有MgCl2和CaCl2的存在,使得食盐容易板结,下面实验可以确定粗盐中NaCl的质量分数,也可以制得纯净的NaCl,实验步骤如下:
①调整托盘天平零点
②称取样品W克
③将样品溶解于适量的蒸馏水
④滴加稍过量的A溶液,有沉淀产生,沉淀完全后过滤
⑤将得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W1克
⑥滤液中加入稍过量的B溶液,又待沉淀完全后过滤
⑦将⑥得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W2克
⑧在最后得的滤液中加入稍过量C溶液,加热蒸发溶剂得到纯净![]() 固体W3克
固体W3克
请根据要求回答问题:
① 加入的试剂A是 ,B是 ,C是 。
②检验步骤④中A是否过量的方法是 。
③两次洗涤沉淀,为了检验沉淀是否洗净,应在最后几滴洗出液中加入 ,若 表示沉淀已洗净。
④ 该粗盐中![]() 的质量分数的计算式是 。
的质量分数的计算式是 。
一般测定样品中成分含量的实验应重复2―3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:
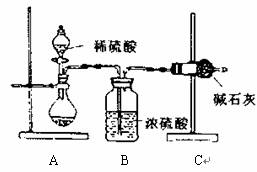
Ⅰ.甲同学的方案如上图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行
次;
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能的原因是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收;
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收;
D.加入稀硫酸的量不足
Ⅱ.乙同学的方案是:从下图所提供的装置中选择实验装置,代替甲同学实验的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
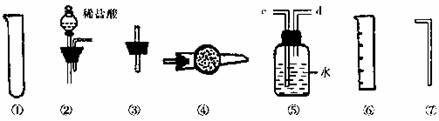
(1)选择最简装置的连接顺序为 ;
(2)产生的气体从装置⑤的 端进入。
Ⅲ.丙同学的方案是:称取样品mg,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ;
(2)Ca2+、Ba2+都可以使CO32-沉淀完全。乙同学能否使用氯化钙溶液代替氯化钡溶液?
为什么? 。
题号
1
2
3
4
5
6
7
8
9
答案
C
D
D
C
D
C
C
C
B
题号
10
11
12
13
14
15
16
17
18
答案
C
A
D
C
D
B
D
A
C
19、(9分)(1)焰色(1分)。
(2)①Na2CO3(1分)静置,在上层清液中继续滴加Na2CO3溶液,若不再有沉淀生成,则加Na2CO3溶液已过量。(2分)
②盐酸(1分)除尽溶液中过量的Na2CO3(1分)
③稀HNO3和AgNO3溶液(1分) (其它合理答案也可)
 |

 ④
(2分,其它合理答案也可)
④
(2分,其它合理答案也可)
|