
题目列表(包括答案和解析)
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
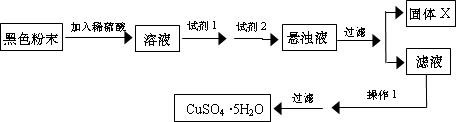
| 实验操作 | 预期现象 | 结 论 | |
| 操作1: | 假设1或假设3成立 | ||
| 操作2: | 假设1成立 | ||
| 假设3成立 | |||
| 操作3: | 假设2或假设3成立 | ||
| 操作4 | 假设2成立 | ||
| 假设3成立 |
题号
1
2
3
4
5
6
7
8
9
答案
C
D
D
C
D
C
C
C
B
题号
10
11
12
13
14
15
16
17
18
答案
C
A
D
C
D
B
D
A
C
19、(9分)(1)焰色(1分)。
(2)①Na2CO3(1分)静置,在上层清液中继续滴加Na2CO3溶液,若不再有沉淀生成,则加Na2CO3溶液已过量。(2分)
②盐酸(1分)除尽溶液中过量的Na2CO3(1分)
③稀HNO3和AgNO3溶液(1分) (其它合理答案也可)
 |

 ④
(2分,其它合理答案也可)
④
(2分,其它合理答案也可)
|