
题目列表(包括答案和解析)
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
A.C(s)+H2O(g)==CO(g)+H2(g):△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O( )+8H2O(
)+8H2O( )△H>0
)△H>0
C.CaC2(s)+2 H2O(![]() )==Ca(OH)2(s)+C2H2(g);△H<0
)==Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)==CO2(g)+2H2O( ):△H<0
):△H<0
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
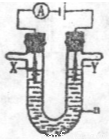
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为 mol。
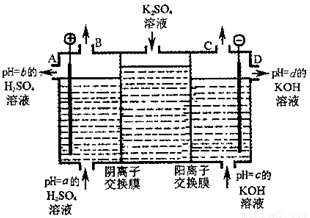
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
① 该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
A.C(s)+H2O(g)==CO(g)+H2(g):△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O(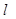 )+8H2O(
)+8H2O(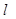 )△H>0
)△H>0
C.CaC2(s)+2 H2O(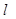 )==Ca(OH)2(s)+C2H2(g);△H<0
)==Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)==CO2(g)+2H2O(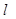 ):△H<0
):△H<0
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为 mol。
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
① 该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
(1) 电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号)。此类反应具备的条件是① 反应,② 反应。
A.C(s)+H2O(g)==CO(g)+H2(g):△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)==BaCl2(aq)+2NH3·H2O(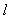 )+8H2O(
)+8H2O(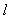 )△H>0
)△H>0
C.CaC2(s)+2 H2O(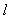 )==Ca(OH)2(s)+C2H2(g);△H<0
)==Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)==CO2(g)+2H2O(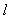 ):△H<0
):△H<0
(2) 以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池。其负极反应为: 。
(3) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
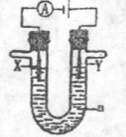 ②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是
。
②若X、Y分别为石墨和铁,a仍为饱和的NaCI溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是
。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和PH,则电解过程中电子转移的物质的量为 mol。
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
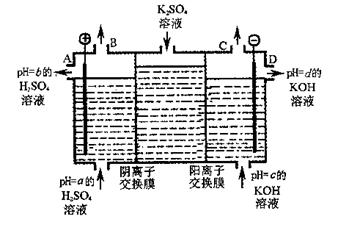 ① 该电解槽的阳极反应式为
,通过阴离子交换膜的离子数
(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
① 该电解槽的阳极反应式为
,通过阴离子交换膜的离子数
(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
 铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2OA.Ag B.Zn(OH)2 C.Ag2O D.Zn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com