
题目列表(包括答案和解析)
化学反应原理在科研和生产中有广泛应用。
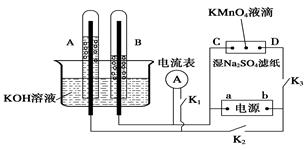
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。

回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。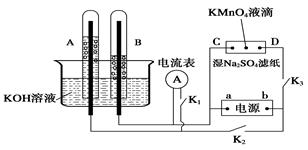
回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
 CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
完成下列问题:?
(1)写出下列物质的化学式:X ,G ,?D ?。?
(2)写出G与C反应生成D的化学方程式:?
。?
(3)写出X+E![]() A的离子方程式: 。?
A的离子方程式: 。?
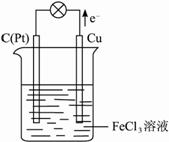
Ⅱ.某反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,试设计一个原电池实现该反应。?
(1)该原电池的电极反应式为:?
正极 ;?
负极 。?
(2)该原电池正极材料为 ,负极材料为 ,电解质溶液是 。?
(3)画出该原电池的示意图,并标出电子流动的方向。?

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
1.A 2.B 3.C 4.B 5.C 6.C 7.B 8.A
9.A 10.C 11.A 12.D 13.B 14.D
15.(共9分)
(1)NO2 (3分)
(2)比较碳酸、醋酸、硅酸的酸性强弱;(3分)B中固体溶解,产生无色气体,C试管中产生白色沉淀(3分)。
16.(17分)
(1)碱性(2分) ClO- + H2O  HClO + OH- (2分)
HClO + OH- (2分)
(2)氧化性 漂白性 不稳定性 (任写两个,每空2分)
(3)CO2等酸性气体、光和热 (2分)
(4)铁钉表面出现铁锈(或红褐色固体) (2分)
(5)铁钉可能未被腐蚀,也可能被腐蚀但无明显现象 (2分)
用试管取出少量浸泡后的溶液,滴加足量的稀硫酸酸化,再滴加几滴KSCN溶液。(3分)
17.(共10分)
(1)取A的样品少量于试管中,加入少量水,若无气泡产生,说明已经完全变质。(2分)
 (2)2Na2SO3+O2=2Na2SO4(2分)
(2)2Na2SO3+O2=2Na2SO4(2分)
(3)SO32-+ClO-= SO42-+Cl- (2分) 2 (2分 )
(4)取H溶液少量于试管中,加入足量Ba(NO3)2溶液,产生白色沉淀,说明含有
SO42-离子;静置,向上层清液中加入少量AgNO3溶液,若产生白色沉淀,说明含有Cl-离子。(2分)
18.(1)蒸发结晶(或蒸发2分)
|