
题目列表(包括答案和解析)
下列关于阿伏加德罗常数(NA),的说法正确的是( )
A.3.2g铜与足量稀硝酸反应过程中转移电子0.1NA
B.35.5g超氧化钾(KO2)所含的阴离子的数目为NA
C.标准状况下将0.5molSO2气体与0.5molH2S气体混合后,气体的分子总数为NA
D.6g二氧化硅中含Si-O键数为0.2NA
| 1 |
| 3 |
| 1 |
| 3 |
(18分)
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是 。
(2)① 如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
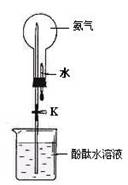
② 氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
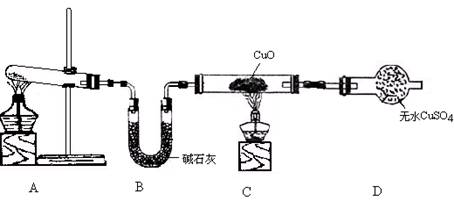
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③ 整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。

Ⅱ. 3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为 mol。
②所生成的NO在标准状况下体积为 L。(以上结果均用含a的代数式表示)
Ⅲ. 某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
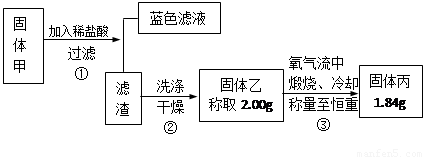
(1)③中在煅烧过程中一定发生的反应的化学方程式为 。
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S。
题号
14
15
16
17
18
19
20
21
答案
BCD
AD
B
C
BD
AC
C
D
22.(18分) (1)ABD;
(2)①
甲, ②150Ω ③E= 或E=
或E= .
.
评分标准:本题共18分.(1)问6分,选对但不全,每选一个给2分,有选错或不选得0分;
(2)问共12分,①4分,②4分,③4分.
23.(15分)解:(1)(0~2)s内物体做匀减速直线运动,设加速度为a1,则有:
 -(F+f )= m a1
-(F+f )= m a1
(2~4)s内物体做匀加速直线运动,设加速度为a2,则有:a2=
F―f = m a2 又f=μmg
所以解得,μ=0.2 (8分)
(2)由F―f = m a2 得
F= m a2 +f= m a2+μmg =150N (8分)
24.解:(1)下端小球从静止进入电场,到运动至下极板速度为零这一过程。
两球组成的系统先做匀加速运动,直至上端小球进入电场后改做匀减速运动,且这两个加速度大小相等。
所以
 ……①5分
……①5分
即 ………………②2分
………………②2分
(2)加速度大小
 …………③5分
…………③5分
下端小球下落距离为L时,球的速度最大。由 3分
3分
得  ………………④3分
………………④3分
25.(20分) 25、解:开始时A处于平衡状态,有
当C下落h高度时速度为 ,则有:
,则有:
C与A碰撞粘在一起时速度为 ,由动量守恒有:
,由动量守恒有:
当A与C运动到最高时,B对地面无压力,即:
可得: 所以最高时弹性势能与初始位置弹性势能相等。
所以最高时弹性势能与初始位置弹性势能相等。
由机械能守恒有:
解得:
化学答案:A A C B C C C A
26:(1)①2H2O+2Na2O2=4NaOH+O2↑ (3分)
② 4NH3(g)十5O2(g)=4NO(g)+6H2O(g);△H= -906.8 kJ?mol-1 (3分)
③ 2Al+2OH一十2H2O=2AlO2-+3H2↑ (3分)
(2) ① 接触室 (2分)
② 2FeCl3+Fe=3FeCl2(2分)
|