
题目列表(包括答案和解析)
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过
l0s达平衡,测得平衡时![]() 的物质的量为0.8mol.
的物质的量为0.8mol.
Ⅱ.容器乙起始投入3molN2、bmolH2,维持恒温、恒压到平衡,测得平衡时![]() 的物质的量为1.2mol。此时与容器甲中平衡状态温度相同、相同组分的体积分数都相同。
的物质的量为1.2mol。此时与容器甲中平衡状态温度相同、相同组分的体积分数都相同。
(1)容器甲10s内用![]() 表示的平均反应速率
表示的平均反应速率![]() = ,达平衡时
= ,达平衡时![]() 的
的
 转化率= .
转化率= .
(2)甲容器中反应的逆反应速率随时间变化的关
系如下图。![]() 时改变了某种条件,改变的条件
时改变了某种条件,改变的条件
可能是 、 。(填写2项)
(3)下列哪些情况表明容器乙已达平衡
状态 。(填字母)
A.容器乙的气体密度不再交化
B.反应的平衡常数不再变化
C.氮气与氨气的浓度相等
D.断裂lmolN![]() N键同时断裂6molN一H键
N键同时断裂6molN一H键
E.容器乙中气体的平均相对分子质量不随时间而变化
(4)b= mol。
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |



氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2%H2O2溶液 | 无 |
② | 10 mL 5%H2O2溶液 | 无 |
③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是________(填一种即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析该图能够得出的实验结论是________。
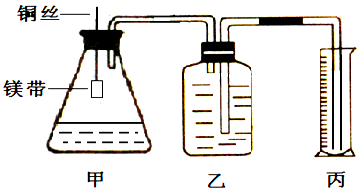
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。

(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量________或________来比较;
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物质的量浓度为________。(保留两位有效数字,在标准状况下测定)

Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸,10 s时收集产生的H2体积为50 mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为______g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |



题号
14
15
16
17
18
19
20
21
答案
BCD
AD
B
C
BD
AC
C
D
22.(18分) (1)ABD;
(2)①
甲, ②150Ω ③E= 或E=
或E= .
.
评分标准:本题共18分.(1)问6分,选对但不全,每选一个给2分,有选错或不选得0分;
(2)问共12分,①4分,②4分,③4分.
23.(15分)解:(1)(0~2)s内物体做匀减速直线运动,设加速度为a1,则有:
 -(F+f )= m a1
-(F+f )= m a1
(2~4)s内物体做匀加速直线运动,设加速度为a2,则有:a2=
F―f = m a2 又f=μmg
所以解得,μ=0.2 (8分)
(2)由F―f = m a2 得
F= m a2 +f= m a2+μmg =150N (8分)
24.解:(1)下端小球从静止进入电场,到运动至下极板速度为零这一过程。
两球组成的系统先做匀加速运动,直至上端小球进入电场后改做匀减速运动,且这两个加速度大小相等。
所以
 ……①5分
……①5分
即 ………………②2分
………………②2分
(2)加速度大小
 …………③5分
…………③5分
下端小球下落距离为L时,球的速度最大。由 3分
3分
得  ………………④3分
………………④3分
25.(20分) 25、解:开始时A处于平衡状态,有
当C下落h高度时速度为 ,则有:
,则有:
C与A碰撞粘在一起时速度为 ,由动量守恒有:
,由动量守恒有:
当A与C运动到最高时,B对地面无压力,即:
可得: 所以最高时弹性势能与初始位置弹性势能相等。
所以最高时弹性势能与初始位置弹性势能相等。
由机械能守恒有:
解得:
化学答案:A A C B C C C A
26:(1)①2H2O+2Na2O2=4NaOH+O2↑ (3分)
② 4NH3(g)十5O2(g)=4NO(g)+6H2O(g);△H= -906.8 kJ?mol-1 (3分)
③ 2Al+2OH一十2H2O=2AlO2-+3H2↑ (3分)
(2) ① 接触室 (2分)
② 2FeCl3+Fe=3FeCl2(2分)
|