
题目列表(包括答案和解析)
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法
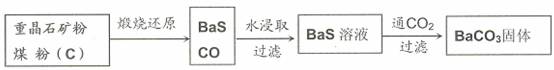
(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H= -1473.2 kJ?mol-1
C(s)+![]() O2(g)=CO(g);△H= -110.5 kJ?mol-1
O2(g)=CO(g);△H= -110.5 kJ?mol-1
Ba(s)+S(s)=BaS(s);△H= -460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32(aq)![]() BaCO3(s)+SO42(aq)(平衡常数K=0.042)
BaCO3(s)+SO42(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H= -1473.2 kJ?mol-1
C(s)+![]() O2(g)=CO(g);△H= -110.5 kJ?mol-1
O2(g)=CO(g);△H= -110.5 kJ?mol-1
Ba(s)+S(s)=BaS(s);△H= -460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):
.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
![]() (3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)![]()
![]() (4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s); △H= -1473.2 kJ?mol-1
C(s)+ ![]() O2(g)=CO(g); △H= -110.5 kJ?mol-1
O2(g)=CO(g); △H= -110.5 kJ?mol-1
Ba(s)+S(s)=BaS(s); △H= -460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32(aq)![]() BaCO3(s)+SO42(aq)(平衡常数K=0.042)
BaCO3(s)+SO42(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com