
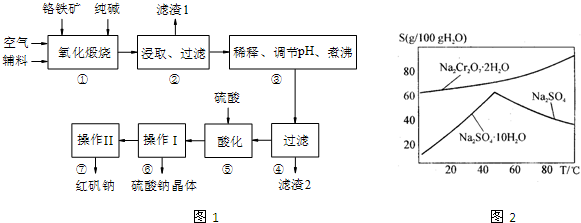
(2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe
2O
3、SiO
2、Al
2O
3、CaO、MgO等.现以此废渣制备铁红(Fe
2O
3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
| 沉淀物 |
开始沉淀pH |
沉淀完全pH |
| Al(OH)3 |
3.0 |
5.2 |
| Fe(OH)3 |
1.5 |
2.8 |
| Fe(OH)2 |
7.6 |
9.7 |
| Mg(OH)2 |
8.0 |
12.4 |
(1)酸溶过程中Fe
2O
3与稀硫酸反应的化学方程式是
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
.
(2)还原过程中加入FeS
2是将溶液中的Fe
3+还原为Fe
2+,而本身被氧化为SO
42-,写出有关的离子方程式:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
.
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:
4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓
4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓
.
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为
2.8
2.8
≤pH<
3.0
3.0
.
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al
2O
3,其原因是(用离子方程式表示):
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.




 (2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
(2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.