
题目列表(包括答案和解析)
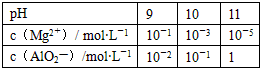
某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1 L。测得部分实验数据如下表:
| pH | 9 | 10 | 11 |
| c(Mg2+)/ mol?L-1 | 10-1 | 10-3 | 10-5 |
| c(AlO2)/mol?L-1 | 10-2 | 10-1 | 1 |
试回答:
(1)若向混合溶液中加入NaOH溶液至pH=9,请用所给的实验数据判断,是否有Mg(OH)2沉淀出现________(填“能”或“否”),由此你得到的初步结论是____________。
(2)若向混合溶液中加入NaOH溶液至pH=10,请写出反应各阶段所发生反应的离子方程式__________,____________,_________________,________________,那么,所加入的NaOH溶液中溶质的物质的量为_____________。
某课外兴趣小组为了探究碱性溶液中Mg2+、AlO-与溶液pH的关系,进行下列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1 L。测得部分实验数据如下表:
| pH | 9 | 10 | 11 |
| c(Mg2+)/ mol·L-1 | 10-1 | 10-3 | 10-5 |
| c(AlO2―)/mol·L-1 | 10-2 | 10-1 | 1 |
试回答:
(1)向混合溶液中加入NaOH溶液至pH=9,能否有Mg(OH)2沉淀出现__________(填“能”或“否”),由此你得到的初步结论是_______________________________。
(2)向混合溶液中加入NaOH溶液至pH=10,需要NaOH溶液中有多少克NaOH?(最后结果保留两位小数)
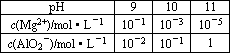
某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1 L.测得部分实验数据如下表:
试回答:
(1)若向混合溶液中加入NaOH溶液至pH=9,请用所给的实验数据判断,有否Mg(OH)2沉淀出现________(填“能”或“否”),由此你得到的初步结论是________.
(2)若向混合溶液中加入NaOH溶液至pH=10,请写出反应各阶段所发生反应的离子方程式________,________,________,________,那么,所加入的NaOH溶液中溶质的的物质的量为________.
 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
| ||
| ||
1.A 2.A 3.C 4.C 5.C 6.B 7.C 8.C 9.A 10.A 11.D
12.B 13.A 14.D 15. A 16.B 17.C 18.A
|