
题目列表(包括答案和解析)
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为 L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式
②在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
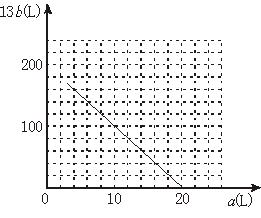
说明:为方便作图,纵坐标用13b表示。
根据方程式的计算、绘制化学图象的能力;应用。
(1)1.00 mol FeS2被完全氧化,需要空气的体积(标准状况)为_________L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为__________L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设氧化FeS2产生的气体混合物为100 L,其中O2为a L,SO2为b L。①写出a和b的关系式。②在下图中画出a和b的关系曲线(氧化FeS2时,空气过量20%)。

说明:为方便作图,纵坐标用13b表示。
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量(g) |
2.812 |
5.624 |
8.436 |
|
生成气体的体积(L)(标准状况) |
1.120 |
2.240 |
2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。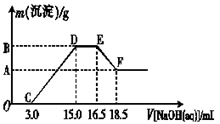
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |

| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
1-5AAAAC 6-10BBC AD AD 11-15CB AD CD 16-20 ABABCA 21-25 ACCBA 26-28CCD
29.8分
(1) 碳(或C) (2分)
(2) 
(3) 35.5
30、(12分)(1)(2分)N≡N; 三角锥(错字不给分)
(2)(6分)  略; H2O2+SO2=H2SO4; 4OH――4e―=O2+
2H2O
略; H2O2+SO2=H2SO4; 4OH――4e―=O2+
2H2O
(3)(2分)水迅速冲入试管的,收集的是氨气;水面缓慢上升的,收集的是SO2;
(4)(2分)c(OH―)< c(NH4+)< c(SO42―)< c(H+)
31、14分(1)Na2SO3、NaOH、Na2SO4(2分)
(2)必须在密闭系统中(或在通风厨中)进行,防止污染空气(或防止中毒)(1分);黑色沉淀中有还原性物质,浓硝酸的氧化性强于浓硫酸。(2分)
(3)硫(或S)(1分),硫微溶于酒精但不溶于水,将硫的酒精溶液倒入水中,即可析出固体硫(1分)
(4)Cu2O+4NH3?H2O=2[Cu(NH3)、2]++2OH―+3H2O(2分)
4[Cu(NH3)2]++8NH3?H2O+O2=4[Cu(NH3)4]2++4OH―+6H2O(2分)
|