
题目列表(包括答案和解析)
下列能达到实验目的的是
① 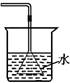 ②
② 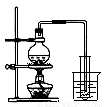 ③
③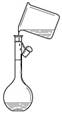 ④
④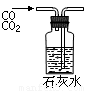
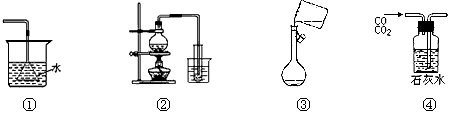
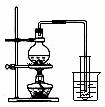
A.①吸收氨气制氨水 B.②制取少量蒸馏水
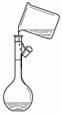
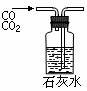
C.③转移溶液 D.④除去杂质气体CO2
下列能达到实验目的的是

① ② ③ ④
A.①吸收氨气制氨水 B.②制取少量蒸馏水
C.③转移溶液 D.④除去杂质气体CO2
下列能达到实验目的的是
①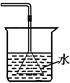 ②
② ③
③ ④
④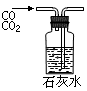
| A.①吸收氨气制氨水 | B.②制取少量蒸馏水 |
| C.③转移溶液 | D.④除去杂质气体CO2 |
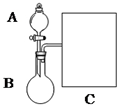 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | |
| 2 |
题号
1
2
3
4
5
6
7
8
答案
A
A
D
B
B
C
B
D
题号
9
10
11
12
13
14
答案
C
BD
B
AC
CD
BC
三、(本题包括1小题,共10分)
15.(10分)
(1)量筒(1分) 22.80(写22.8不得分)(1分)
(2)①0.6(1分) ②酚酞(1分) 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)= (2分)
(2分)
④B(2分)
四、(本题包括1小题,共12分)
16.(每空均2分,共12分)
(1)B (2)D (3)B、A (4)ABCD
(5)①Cu+H2SO4+H2O2=CuSO4+2H2O;
②H2O2 +

 +H2O;
+H2O;
五、(本题包括2小题,共18分)
17、(10分)
(1)2Fe2++Cl2=2Fe3+(2分) H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol(2分)
 |
 (2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
(2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
|