
题目列表(包括答案和解析)

| ||
| ||


 F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
 F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)______.
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)______.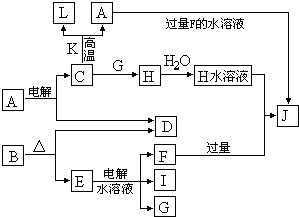
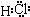
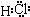
| ||
| ||
| ||
| ||
 已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.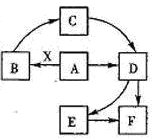
题号
1
2
3
4
5
6
7
8
答案
A
A
D
B
B
C
B
D
题号
9
10
11
12
13
14
答案
C
BD
B
AC
CD
BC
三、(本题包括1小题,共10分)
15.(10分)
(1)量筒(1分) 22.80(写22.8不得分)(1分)
(2)①0.6(1分) ②酚酞(1分) 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)= (2分)
(2分)
④B(2分)
四、(本题包括1小题,共12分)
16.(每空均2分,共12分)
(1)B (2)D (3)B、A (4)ABCD
(5)①Cu+H2SO4+H2O2=CuSO4+2H2O;
②H2O2 +

 +H2O;
+H2O;
五、(本题包括2小题,共18分)
17、(10分)
(1)2Fe2++Cl2=2Fe3+(2分) H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol(2分)
 |
 (2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
(2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
|