
题目列表(包括答案和解析)
[ ]
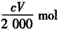
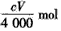
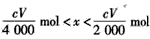
加热一定量的 碳酸氢钠固体至200℃,将产生的全部气体用足量的过氧化钠粉末完全吸收得到固体M,取一定量的固体M与V mL C mol·L—
碳酸氢钠固体至200℃,将产生的全部气体用足量的过氧化钠粉末完全吸收得到固体M,取一定量的固体M与V mL C mol·L— 1盐酸恰好完全反应得到中性溶液和混合气体X,则混合气体X的物质的量为(不考虑溶液中溶解气体) ( )
1盐酸恰好完全反应得到中性溶液和混合气体X,则混合气体X的物质的量为(不考虑溶液中溶解气体) ( )
A.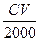 mol mol | B.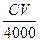 mol mol | C.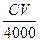 mol<n(X)< mol<n(X)<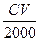 mol mol | D.无法计算 |
 碳酸氢钠固体至200℃,将产生的全部气体用足量的过氧化钠粉末完全吸收得到固体M,取一定量的固体M与V mL C mol·L—
碳酸氢钠固体至200℃,将产生的全部气体用足量的过氧化钠粉末完全吸收得到固体M,取一定量的固体M与V mL C mol·L— 1盐酸恰好完全反应得到中性溶液和混合气体X,则混合气体X的物质的量为(不考虑溶液中溶解气体) ( )
1盐酸恰好完全反应得到中性溶液和混合气体X,则混合气体X的物质的量为(不考虑溶液中溶解气体) ( )A.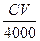 mol mol | B.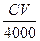 mol mol | C.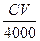 mol<n(X)< mol<n(X)<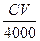 mol mol | D.无法计算 |
| 温度℃ 溶解度 溶质 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
A.3∶1 B.2∶
一、选择题
|