
题目列表(包括答案和解析)
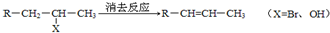

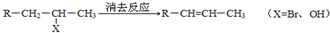
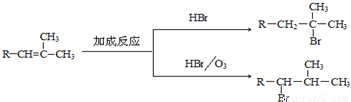

 ”,且当两“-CH3”上的H再被一个同种卤素原子取代成为二卤代烃时,只能得到一种结构.回答下列问题:
”,且当两“-CH3”上的H再被一个同种卤素原子取代成为二卤代烃时,只能得到一种结构.回答下列问题:


 ”,且当两“-CH3”上的H再被一个同种卤素原子取代成为二卤代烃时,只能得到一种结构.回答下列问题:
”,且当两“-CH3”上的H再被一个同种卤素原子取代成为二卤代烃时,只能得到一种结构.回答下列问题: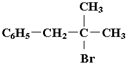

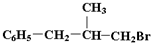
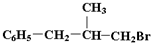


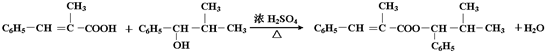
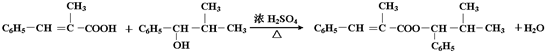
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡????????????????????
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小???????
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:

写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则

①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
生物部分
BDDCBC
30.Ⅰ.(1)光强 低
(2)气孔开度影响二氧化碳进入叶片的量。气孔开度越大,进入叶片的二氧化碳越多,光合速率越高
(3)日出后光合速率逐渐提高,达到高峰后逐渐降低 (4)三碳化合物
Ⅱ.适宜的可见光 同等强度的可见光和一定强度的紫外光
高度(生长状况和高度) 两组植株中3-亚甲基氧代吲哚含量
甲组植株生长高于乙组,甲组中3-亚甲基氧代吲哚含量少于乙组。
31.Ⅰ.(1) 基因突变 (变异来源) X 显 礼服 白金
(2)请你用遗传图解解释此现象。(要求写出配子)
遗传图解(略)
(3) 雄,二。
Ⅱ。(1)生殖隔离 (2) 基因重组(3)aabb(写出两对隐性基因即可)
化学部分
BBACCAC
26.(1)①(NH4)2CO3[或NH4HCO3] ②吸收水和二氧化碳
(2) ①4NH3+5O2 4NO+6H2O
2NO+O2====2NO2
4NO+6H2O
2NO+O2====2NO2
②2NO2(气) N2O4(气)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4。
N2O4(气)+热量,降低温度使平衡正向移动,部分红棕色NO2转化为无色N2O4。
(3)①先通入O2,后通入NH3。若先通氨气,氨在空气中不能点燃,逸出造成污染。
②4NH3+3O2 2N2+6H2O
2N2+6H2O
27.(1)2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ?mol-1
2SO3(g) △H=-196.6 kJ?mol-1
(2) Al2(SO4)3 H2SO4或H2SO3或H2CO3(其它合理答案也可) 1014―
(3)① 4H+ + AlO2- = Al3+ + 2H2O(1分)Al3+ + 3 AlO2- +6H2O = 4Al(OH)3↓(2分)
②c(Na+)>c(SO42-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-)(3分)
28.(1)2Mg+CO2=2MgO+C
(2)将D溶液在HCl气流中蒸干
(3)②4NH3+5O2  4NO+6H2O
4NO+6H2O
(4)C+4HNO3(浓) CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
(5)2NH4++2e- = 2NH3↑+H2↑
29.(10分)I (1) 1 3 (2)A、D (3)保护D分子中其他羟基不被氧化
 (4)
(4) II
II
物理部分
二、选择题(每小题6分,共48分)
14
15
16
17
18
19
20
21
A
B
A
C
CD
AD
B
AC
第II卷
 22.(1)①如图(4分) ②23-26(4分)
22.(1)①如图(4分) ②23-26(4分)
 (2)①ABDF……………………(3分)
(2)①ABDF……………………(3分)
②如图右所示.……………………(3分)
③大于23W小于24W;……………(3分)
④
23.(15分)
(1)t=0.5s 2分
VX=
V0= m/s 3分
m/s 3分
(2)由平抛运动得vt=1m/s 2分
a=12m/s2 3分
f=1.2mg 2分
24.(17分)(1)由机械能守恒定律得:Mgh-mgh= (M+m)v
(M+m)v ①(3分)
①(3分)
解得v1= ②(3分)
②(3分)
(2)设线框ab边进入磁场Ⅱ时速度为v2,则线框中产生的感应电动势:
E=2BLv2 ③(2分)
线框中的电流I= ④(1分)
④(1分)
线框受到的安培力F=2IBL= ⑤(3分)
⑤(3分)
设绳对A1、A2的拉力大小为T,则:
对A1:T+F=Mg ⑥(1分)
对A2:T=mg ⑦(1分)
联立⑤⑥⑦解得:v2= ⑧(3分)
⑧(3分)
25.(22分)
解析:(1)由 ,即重力与电场力平衡
,即重力与电场力平衡
|