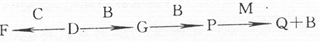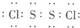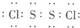现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题:
(1)E、F气态氢化物的稳定性为
HCl
HCl
>
H2S
H2S
(用化学式表示).
(2)E与F可形成E
2F
2的化合物,其电子式为
,其晶体类型为
分子晶体
分子晶体
.
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为:
Na2O2+S2-+2H2O=S↓+2Na++4OH-
Na2O2+S2-+2H2O=S↓+2Na++4OH-
.
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为
.
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为:
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
.
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为:
2Na(s)+O
2(g)=Na
2O
2(s)△H=-
kJ/mol
2Na(s)+O
2(g)=Na
2O
2(s)△H=-
kJ/mol
.

 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。