
题目列表(包括答案和解析)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
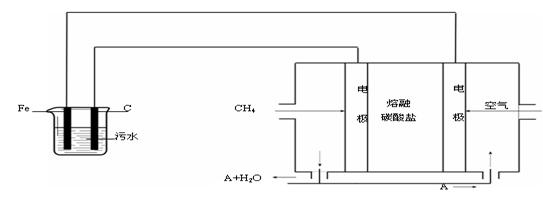
(1)上图中熔融碳酸盐中碳酸根离子的定向移动方向是 (填“向左”或“向右”)。实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① 。②4OH-- 4 e-= 2H2O + O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以 为原料制备少量高纯
为原料制备少量高纯 的操作步骤如下
的操作步骤如下

 溶液:在烧瓶中(装置见上图(左))加入一定量
溶液:在烧瓶中(装置见上图(左))加入一定量 和水,搅拌,通入
和水,搅拌,通入 和
和 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知 )。
)。 尽可能转化完全,在通入
尽可能转化完全,在通入 和
和 比例一定、不改变固液投料的条件下,可采取的合理措施有__________________、_____________________。
比例一定、不改变固液投料的条件下,可采取的合理措施有__________________、_____________________。 换成空气,测得反应液中
换成空气,测得反应液中 的浓度随反应时间t变化如上图(右)。导致溶液中
的浓度随反应时间t变化如上图(右)。导致溶液中 浓度变化产生明显差异的原因是________________________。
浓度变化产生明显差异的原因是________________________。 固体:已知
固体:已知 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解; 开始沉淀时,
开始沉淀时, 。请补充由(1)制得的溶液制备高纯的操作步骤[实验中可选用的试剂:
。请补充由(1)制得的溶液制备高纯的操作步骤[实验中可选用的试剂: ]。
]。



| ||
| △ |
| ||
| △ |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com