
题目列表(包括答案和解析)
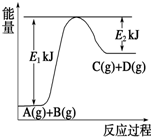 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
| 序号 | 气体 | 装置连接顺序(填字母) | 制作反应的化学方程式 | ||||||
| (1) | 乙烯 | B→D→E B→D→E |
CH3-CH2-OH
CH3-CH2-OH
| ||||||
| (2) | 乙炔 | A→C→E | CaC2+2H2O=Ca(OH)2+C2H2↑ CaC2+2H2O=Ca(OH)2+C2H2↑ |
| 催化剂 |
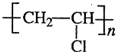 .
.| 催化剂 |
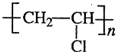 .
.| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
 O2↑+2H2O
O2↑+2H2O O2↑+2H2O
O2↑+2H2O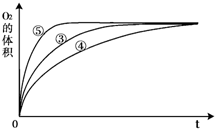

| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |

一、选择题
CDCCD
|