
题目列表(包括答案和解析)



某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为:
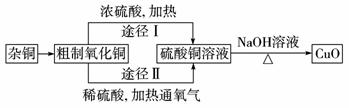
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是____________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:____________
____________ 。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是____________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
(10分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上冷却,不能直接放在桌面上。
所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、_____、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是:
、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中,若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
一、选择题
CDCCD
|