
题目列表(包括答案和解析)
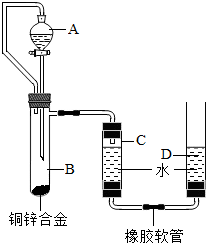 小黄用如图装置测定铜锌合金中锌的质量分数和锌的相对原子质量.主要实验步骤如下(必要的固定装置已略去):①连接装置并检查装置气密性;②加入药品和水;③记录C中液面刻度(C为带有刻度的玻璃管);④由A向B中滴加试剂至过量;⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为VmL(经查,该气体密度为ρ g/L);⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为Wg.
小黄用如图装置测定铜锌合金中锌的质量分数和锌的相对原子质量.主要实验步骤如下(必要的固定装置已略去):①连接装置并检查装置气密性;②加入药品和水;③记录C中液面刻度(C为带有刻度的玻璃管);④由A向B中滴加试剂至过量;⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为VmL(经查,该气体密度为ρ g/L);⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为Wg.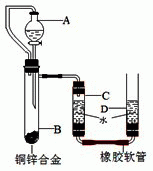
小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ;
(2)B中发生的反应的化学方程式为: ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ;
(4)如何检验该装置的气密性: ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):

①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ;
(2)B中发生的反应的化学方程式为: ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ;
(4)如何检验该装置的气密性: ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
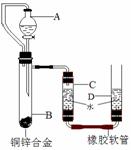
小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ;
(2)B中发生的反应的化学方程式为: ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ;
(4)如何检验该装置的气密性: ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。

一、选择
1
2
3
4
5
6
7
8
9
10
11
12
C
A
C
C
C
C
C
B
B
A
C
B
二、填空
13.+4;后两空评分要求:写错化学式得0分,不配平、不标反应条件每空共扣0.5分。TiO2 +  TiCl4
+ 2CO 2Mg + TiCl4
TiCl4
+ 2CO 2Mg + TiCl4  2MgCl2
+ Ti
2MgCl2
+ Ti
 14.
14.
15.(1)Cu 和Al2(SO4)3[或Al2(SO4)3和Cu] (2) C或CO或H2或酸等任填一个 (3) 6CO2+6H20=C6H12O6+6O2 (4)18
16.(1)H2CO3=H2O+CO2↑或2H2O2 MnO2 2H2O+O2↑ (2)2H2+O2 点燃 2H2O
(3) NaOH+HCl=NaCl+H2O (4)CH4+2O2 点燃 2H2O+CO2 或 H2+CuO △ H2O+Cu
三、简答
18. ⑴置换 复分解 ⑵ (合理即可)⑶NaOH Fe2O3 2NaOH+H2SO4==Na2SO4+2H2O(合理即可)
19.(1)二氧化氯 +4 (2)Cl2 +2NaClO2==2ClO2+2NaCl

20.3CO+Fe2O3 2Fe+3CO2(2分) Fe2O3+6HCl=2FeCl3+3H2O(2分) 复分解
21.(1)(3分)光(1分) 4Al + 3O2 ==2 Al2O3(2分)(2)(3分)2H2+O2 点燃 2H2O(2分) 燃烧产物无污染(或产物是水,1分)(3)(2分)聚乙烯 Cl2
 四、实验与探究
四、实验与探究
22. (1)N2 + 3 H2 2 NH3
(2)⑤④①②③(3)H2O + CO2
= H2CO3 2
CO + 2 NO N2
+ 2 CO2
N2
+ 2 CO2
23. ①BaCl2+Na2S04=BaS04↓+2NaCl Na
五、计算
24. 20.2%
25. 解: (1)由图可知,生成BaSO4沉淀的质量为
(2)设BaCl2的质量为x,生成NaCl的质量为y
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
208 233 117
X
x=
y=
溶液的总质量=
溶质的总质量=
NaCl%=20/200×100%= 10% (1分)
答:生成沉淀
(注:其他解法,只要合理,结果正确,均可给分。)
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com